
| A. | $\frac{M}{10Sd}$ mol•L-1 | B. | $\frac{100Sd}{M(100+S)}$ mol•L-1 | ||
| C. | $\frac{10Sd}{M}$mol•L-1 | D. | $\frac{M(100+S)}{1000Sd}$ mol•L-1 |
分析 该物质溶解度为Sg,则饱和溶液质量分数为$\frac{s}{100+s}$,再根据c=$\frac{1000ρω}{M}$计算饱和溶液物质的量浓度.
解答 解:某温度下该物质溶解度为Sg,则饱和溶液质量分数为$\frac{s}{100+s}$,此时饱和溶液的密度为dg•mL-1,根据c=$\frac{1000ρω}{M}$可知,该饱和溶液物质的量浓度为$\frac{1000×d×\frac{s}{100+s}}{M}$mol/L=$\frac{100sd}{M(100+s)}$mol/L,故选:B.
点评 本题考查物质的量浓度有关计算,注意理解掌握物质的量浓度与质量分数之间关系,注意对定义式的理解掌握.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:填空题

| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.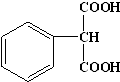 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 铝离子中的质子数和电子数之比为13:10 | |
| D. | 原子核内有30个中子的铁原子:2656Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A与气体B的相对分子质量之比为m:n | |
| B. | 同质量的气体A与气体B,所含分子数目之比为n:m | |
| C. | 相同条件下,等体积的气体A与气体B的质量之比为m:n | |
| D. | 相同条件下,气体A与气体B的密度之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com