
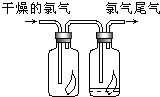
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色分析 (1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;
(2)利用氯气和氢氧化钠溶液反应来处理尾气;
(3)氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水;漂白粉的有效成分是Ca(ClO)2,漂白粉溶于水后,受空气中的CO2作用,生成碳酸钙和次氯酸;漂白粉能漂白或消毒的主要原因是次氯酸钙和二氧化碳溶液中发生反应生成碳酸钙和次氯酸,水溶液中次氯酸具有漂白性和强氧化性,复分解反应中酸性强的可以制备酸性弱的酸;
解答 解:(1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;Cl2+H2O=HCl+HClO;干燥的有色布条无明显现象,潮湿的有色布条褪色,
故答案为:干燥的有色布条无明显现象,潮湿的有色布条褪色;
(2)为了防止氯气尾气污染空气,可用NaOH溶液吸收,该反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O;
(3)氯气和氢氧化钙反应:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分是Ca(ClO)2,次氯酸钙和二氧化碳反应:Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,漂白粉能漂白或消毒的主要原因是次氯酸钙和二氧化碳溶液中发生反应生成碳酸钙和次氯酸,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HCl,水溶液中次氯酸具有漂白性和强氧化性,复分解反应中酸性强的可以制备酸性弱的酸,所以说明碳酸酸性大于次氯酸,
故答案为:Ca(ClO)2;2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HCl;弱;
点评 本题考查了氯气化学性质的应用、氯气的处理方法,明确具有漂白性的是次氯酸是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | NO、O2、H2 | D. | SO2、CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
 ;由H和①形成的原子数之比为1:1的物质
;由H和①形成的原子数之比为1:1的物质 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象与结论(或装置用途) |
| A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
| B | 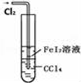 | 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
| C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
| D | 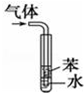 | 用于吸收HCl气体能防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I基态原子的电子运动状态有78种 | |
| B. | 碘盐中含有${\;}_{53}^{131}$I | |
| C. | ${\;}_{53}^{131}$I的中子数与质子数的差是25 | |
| D. | ${\;}_{53}^{131}$I有放射性而${\;}_{53}^{126}$I没有,故它们核外电子排布不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{49}^{115}$In原子核外有49个电子 | |
| B. | ${\;}_{49}^{115}$In原子核内有49个中子 | |
| C. | ${\;}_{49}^{115}$In原子核内质子数和中子数之和等于其质量数,为115 | |
| D. | ${\;}_{49}^{115}$In是In元素的一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
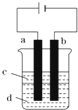 Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.
Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
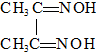 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.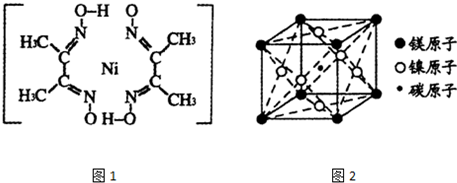
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com