
| A、副族元素次外层的d能级上的电子数均未达到10个 |
| B、短周期元素的内层电子均达到了饱和 |
| C、主族元素的次外层电子数为2个或8个或18个 |
| D、第三周期元素的次外层电子均为8个 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、3.4g NH3中含N-H键数目为0.2NA |
| B、1L 0.1mol?L-1 HClO溶液中H+数为0.1NA |
| C、标准状况下,22.4L C2H5OH中含有的氢原子数为6NA |
| D、常温常压下,92g的NO2和N2O4混合气体含有的原子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaN3中氮元素的化合价为-3 |
| B、氧化剂和还原剂是同一物质 |
| C、反应过程中若转移1mol电子,则产生2.24L气体(标准状况) |
| D、被氧化的氮原子与生成的氮气分子个数之比为15:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的原子序数X>Y>Z |
| B、原子最外层上的电子数Z>X>Y |
| C、Z的单质可以从NaBr溶液中置换出Br2 |
| D、X的最高价氧化物对应水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是( )
在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是( )| A、铁端将附着铜增重下沉 |
| B、铜端将附着铜增重下沉 |
| C、铁端将变细减重上升 |
| D、铜端粗细不变将下沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在密闭容器中,使1mol N2与3mol H2充分反应后生成NH3的分子数为2NA |
| B、标准状况下,4.48L N2中含有的共用电子对数为0.2NA |
| C、常温常压下,1mol NaHSO4晶体中含有的离子总数为2NA |
| D、标准状况下,1mol Fe与2.24L Cl2完全反应后转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.4g白磷晶体中含有的P-P键数是0.6NA |
| B、2.9g熟石膏2CaSO4?H2O 含有的结晶水分子数为0.02NA |
| C、100g的98%的浓 H2SO4中所含的硫原子数为NA |
| D、2mol SO2和1mol O2混合在一定条件下密闭容器中加热反应后,容器内物质分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
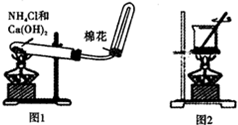
| A、用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色火焰,则该溶液中一定不含K+ |
| B、将氯水点到蓝色石蕊试纸上,试纸接触点先变红后褪色,说明氯水中含H+具有酸性,含Cl2而具有漂白性 |
| C、如图1装置可用于实验室制备氨气 |
| D、如图2装置可灼烧海带成灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com