
”¾ĢāÄæ”æÖŠ¹ś¹Å“śĖÄ“ó·¢Ć÷Ö®Ņ»ŗŚ»šŅ©£¬ĖüµÄ±¬ÕØ·“Ó¦ĪŖ£ŗS +2KNO3+3C © A+N2”ü+3CO2”ü£ØŅŃÅäĘ½£©
£Ø1£©³żSĶā£¬ÉĻŹöŌŖĖŲµÄµēøŗŠŌ“ÓŠ”µ½“óŅĄ“ĪĪŖ_______”£³żK”¢SĶāµŚŅ»µēĄėÄܓӓ󵽊”µÄĖ³ŠņĪŖ______________”£
£Ø2£©ŌŚÉś³ÉĪļÖŠ£¬AĪŖ______»ÆŗĻĪļ£¬CO2ĪŖ_______»ÆŗĻĪļ£ØĢī”°Ąė×Ó»ÆŗĻĪļ”±»ņ¹²¼Ū»ÆŗĻĪļ£©£¬ŗ¬¼«ŠŌ¹²¼Ū¼üµÄ·Ö×ÓµÄÖŠŠÄŌ×Ó¹ģµĄŌÓ»ÆĄąŠĶĪŖ______________”£
£Ø3£©CN©ÓėN2»„ĪŖ______£¬Š“³öCN©µÄµē×ÓŹ½________”£ĶĘĖćHCN·Ö×ÓÖŠ¦Ņ¼üÓė¦Š¼üŹżÄæÖ®±Č_________
”¾“š°ø”æO>N>C>K N£¾O£¾C Ąė×Ó ¹²¼Ū sp µČµē×ÓĢ壻 ![]() 1£ŗ1
1£ŗ1
”¾½āĪö”æ
£Ø1£©·Ē½šŹōŠŌŌ½Ē棬µēøŗŠŌŌ½Ē棬µŚŅ»µēĄėÄÜĶ¬ÖÜĘŚŌŖĖŲ“Ó×óµ½ÓŅŌöĒæĒ÷ŹĘ£¬µ«ŹĒ¢ņA×å¢õA×åŌŖĖŲ±ČĻąĮŚŌŖĖŲ¶¼øߣ®
£Ø2£©ÓÉŌ×ÓŹŲŗćĶĘ²āĪļÖŹA£¬ŗ¬¼«ŠŌ¹²¼Ū¼üµÄ·Ö×ÓŹĒCO2£¬ĪŖ¹²¼Ū»ÆŗĻĪļ£¬ÓÉ·Ö×Ó½į¹¹ĶĘ²āŌÓ»ÆĄąŠĶ£»
£Ø3£©Ėłŗ¬Ō×ÓŹżĻąĶ¬£¬ĒŅ¼Ūµē×ÓŹżŅ²ĻąĶ¬µÄ·Ö×Ó»ņĄė×Ó»„ĪŖµČµē×ÓĢ壬µČµē×ÓĢåµÄ×é³ÉĻąĖĘ£¬½ų¶ųŠ“³öCN-µÄµē×ÓŹ½ÓėHCNµÄ½į¹¹Ź½£¬“ÓÖŠÕŅ³ö¦Ņ¼üÓė¦Š¼üŹżÄ攣
£Ø1£©Ķ¬ÖÜĘŚŌŖĖŲ“Ó×óµ½ÓŅµēøŗŠŌŌöĒ棬½šŹōŠŌŌ½ĒæµÄŌŖĖŲµēøŗŠŌŌ½Š”£¬¹ŹO>N>C>K£»Ķ¬ÖÜĘŚŌŖĖŲµŚŅ»µēĄėÄÜ“Ó×óµ½ÓŅ³ŹŌö“óĒ÷ŹĘ£¬ÓÉÓŚNµÄŗĖĶā2p¹ģµĄÅÅ3øöµē×Ó£¬°ė³äĀś£¬½ĻĪČ¶Ø£¬±ČĻąĮŚŌŖĖŲµÄµŚŅ»µēĄėÄܶ¼øߣ¬
¹Ź“š°øĪŖ£ŗO>N>C>K£»N>O>C£»
£Ø2£©ÓÉŌ×ÓŹŲŗćæÉÖŖAĪŖK2S£¬ÓÉŅõŃōĄė×ÓĶعżĄė×Ó¼üŠĪ³É£¬¼“ĪŖĄė×Ó¾§Ģ壻CO2ŹĒÓɼ«ŠŌ¼ü×é³ÉµÄ¹²¼Ū»ÆŗĻĪļ£¬ŗ¬¼«ŠŌ¹²¼Ū¼üµÄ·Ö×ÓĪŖCO2£¬Ö±ĻߊĪ·Ö×Ó£¬Ö±ĻߊĪ·Ö×ÓµÄŌÓ»ÆĄąŠĶĪŖsp”£
¹Ź“š°øĪŖ£ŗĄė×Ó¾§Ģ壻¹²¼Ū£»sp£»
£Ø3£©CNÓėN2ÓÉĮ½øöŌ×Ó¹¹³É£¬¼Ū²ćµē×ÓŹż¾łĪŖ10£¬Ō×ÓøöŹż”¢¼Ū²ćµē×ÓŹżĻąµČµÄĪļÖŹ»„ĪŖµČµē×ÓĢ壬ŅņµČµē×ÓĢåµÄ×é³ÉĻąĖĘ£¬ĖłŅŌCNÄŚ²æCÓėNÖ®¼äŅ²ŹĒ¹²¼ŪČż¼ü£¬Ęäµē×ÓŹ½ĪŖ£ŗ![]() £¬HCN½į¹¹Ź½ĪŖHC”ŌN£¬µ„¼üĪŖ¦Ņ¼ü£¬Čż¼üÖŠÓŠ1øö¦Ņ¼ü£¬2øö¦Š¼ü£¬¼“Ņ»øöHCN·Ö×ÓÖŠĮ½øö¦Ņ¼üÓė2øö¦Š¼ü£¬
£¬HCN½į¹¹Ź½ĪŖHC”ŌN£¬µ„¼üĪŖ¦Ņ¼ü£¬Čż¼üÖŠÓŠ1øö¦Ņ¼ü£¬2øö¦Š¼ü£¬¼“Ņ»øöHCN·Ö×ÓÖŠĮ½øö¦Ņ¼üÓė2øö¦Š¼ü£¬
¹Ź“š°øĪŖ£ŗµČµē×ÓĢ壻![]() £»1:1”£
£»1:1”£


 ¾«Ó¢æŚĖćæØĻµĮŠ“š°ø
¾«Ó¢æŚĖćæØĻµĮŠ“š°ø Ó¦ÓĆĢāµć²¦ĻµĮŠ“š°ø
Ó¦ÓĆĢāµć²¦ĻµĮŠ“š°ø דŌŖ¼°µŚĻµĮŠ“š°ø
דŌŖ¼°µŚĻµĮŠ“š°ø Ķ¬²½°ĀŹżĻµĮŠ“š°ø
Ķ¬²½°ĀŹżĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÕżČ·µÄŹĒ(””””)
A.½«5.85 g NaCl¾§ĢåČÜČė100 mLĖ®ÖŠ£¬ÖʵĆ1 mol”¤L£1NaClČÜŅŗ
B.½«1Ģå»żc mol”¤L£1ĮņĖį¼ÓČėĖ®ÖŠĻ”ŹĶĪŖ5Ģå»ż£¬µĆµ½0.2c mol”¤L£1ĮņĖį
C.½«25 gĪŽĖ®CuSO4ČÜÓŚĖ®ÅäÖĘ³É100 mLČÜŅŗ£¬ĘäÅضČĪŖ1 mol”¤L£1
D.ÓĆÅØŃĪĖįÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄĻ”ŃĪĖį£¬ĮæČ”ÅØŃĪĖįŹ±ŃöŹÓĮæĶ²µÄæĢ¶ČĻß»įµ¼ÖĀĖłÅäČÜŅŗÅضČĘ«µĶ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A. ![]() ¹ĢĢåŗ¬ÓŠĄė×ӵďżÄæĪŖ
¹ĢĢåŗ¬ÓŠĄė×ӵďżÄæĪŖ![]()
B. ³£ĪĀĻĀ£¬![]() µÄ“×ĖįČÜŅŗÖŠH+ŹżÄæĪŖ
µÄ“×ĖįČÜŅŗÖŠH+ŹżÄæĪŖ![]()
C. 13gÓÉ![]() CŗĶ
CŗĶ![]() ×é³ÉµÄĢ¼µ„ÖŹÖŠĖłŗ¬ÖŹ×ÓŹżŅ»¶ØĪŖ
×é³ÉµÄĢ¼µ„ÖŹÖŠĖłŗ¬ÖŹ×ÓŹżŅ»¶ØĪŖ![]()
D. ![]() Óė×ćĮæ
Óė×ćĮæ![]() ŌŚŅ»¶ØĢõ¼žĻĀ»ÆŗĻ£¬×ŖŅʵē×ÓŹżĪŖ
ŌŚŅ»¶ØĢõ¼žĻĀ»ÆŗĻ£¬×ŖŅʵē×ÓŹżĪŖ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»ÆŹĒÓÉ»Æѧ·“Ó¦ÖŠ¾É»Æѧ½”¶ĻĮŃŹ±ĪüŹÕµÄÄÜĮæÓė»Æѧ½”ŠĪ³ÉŹ±·Å³öµÄÄÜĮæ²»Ķ¬ŅżĘšµÄ”£ČēĶ¼ĪŖN2(g)ŗĶO2(g)·“Ӧɜ³ÉNO(g)¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ

A. 1molN2(g)ŗĶ1molO2(g)·“Ó¦·Å³öµÄÄÜĮæĪŖ180kJ
B. 1molN2(g)ŗĶ1molO2(g)¾ßÓŠµÄ×ÜÄÜĮæŠ”ÓŚ2molNO(g)¾ßÓŠµÄ×ÜÄÜĮæ
C. ŌŚ1LµÄČŻĘ÷ÖŠ·¢Éś·“Ó¦£®10minÄŚN2¼õÉŁĮĖ1mol£¬Ņņ“Ė10minÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖv(NO)=0£®1mol/(L”¤min)
D. NOŹĒŅ»ÖÖĖįŠŌŃõ»ÆĪļ£¬ÄÜÓėNaOHČÜŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĆęÓŠ¹Ų»Æѧ·“Ó¦ĖŁĀŹŗĶĻŽ¶ČµÄĶ¼ĻńŗĶŹµŃé½įĀŪ±ķ“ļ¾łÕżČ·µÄŹĒ( )
A.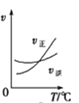 A(g)+3B(g)2C(g)£¬ČēĶ¼ŹĒĘäĖūĢõ¼žŅ»¶ØŹ±·“Ó¦ĖŁĀŹĖęĪĀ¶Č±ä»ÆµÄĶ¼Ļń£¬Ķ¼Ļń±ķĆ÷£¬½ĻµĶĪĀ¶ČĻĀÉżĪĀĘ½ŗāÄęĻņŅĘ¶Æ£¬½ĻøßĪĀ¶ČĻĀÉżĪĀĘ½ŗāÕżĻņŅʶÆ
A(g)+3B(g)2C(g)£¬ČēĶ¼ŹĒĘäĖūĢõ¼žŅ»¶ØŹ±·“Ó¦ĖŁĀŹĖęĪĀ¶Č±ä»ÆµÄĶ¼Ļń£¬Ķ¼Ļń±ķĆ÷£¬½ĻµĶĪĀ¶ČĻĀÉżĪĀĘ½ŗāÄęĻņŅĘ¶Æ£¬½ĻøßĪĀ¶ČĻĀÉżĪĀĘ½ŗāÕżĻņŅʶÆ
B.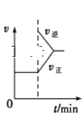 FeCl3+3KSCNFe(SCN)3+3KCl£¬ČēĶ¼ŹĒŌŚĘ½ŗāĢåĻµµÄČÜŅŗÖŠ¼ÓČėÉŁĮæKCl¾§Ģåŗó»Æѧ·“Ó¦ĖŁĀŹĖꏱ¼äµÄ±ä»Æ
FeCl3+3KSCNFe(SCN)3+3KCl£¬ČēĶ¼ŹĒŌŚĘ½ŗāĢåĻµµÄČÜŅŗÖŠ¼ÓČėÉŁĮæKCl¾§Ģåŗó»Æѧ·“Ó¦ĖŁĀŹĖꏱ¼äµÄ±ä»Æ
C.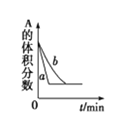 A(g)+3B(g)2C(g)£¬ČēĶ¼æÉÄÜŹĒ“߻ƼĮ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬Ņ²æÉÄÜŹĒĘäĖüŅņĖŲ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ
A(g)+3B(g)2C(g)£¬ČēĶ¼æÉÄÜŹĒ“߻ƼĮ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬Ņ²æÉÄÜŹĒĘäĖüŅņĖŲ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ
D.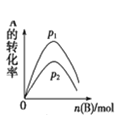 A(g)+3B(g)2C(g)£¬ČēĶ¼ŹĒŅ»¶ØĢõ¼žĻĀ£¬Ļņŗ¬ÓŠŅ»¶ØĮæAµÄČŻĘ÷ÖŠÖš½„¼ÓČėBŹ±µÄĶ¼Ļń£¬Ń¹Ēæp1£¾p2
A(g)+3B(g)2C(g)£¬ČēĶ¼ŹĒŅ»¶ØĢõ¼žĻĀ£¬Ļņŗ¬ÓŠŅ»¶ØĮæAµÄČŻĘ÷ÖŠÖš½„¼ÓČėBŹ±µÄĶ¼Ļń£¬Ń¹Ēæp1£¾p2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”浞µŖ»ÆÄĘ(NaN3)ŹĒŅ»ÖÖ°×É«¾ē¶¾¾§Ģ壬ŹĒĘū³µ°²Č«ĘųÄŅµÄÖ÷ŅŖ³É·Ö”£NaN3Ņ×ČÜÓŚĖ®£¬Ī¢ČÜÓŚŅŅ“¼£¬Ė®ČÜŅŗ³ŹČõ¼īŠŌ£¬ÄÜÓėĖį·¢Éś·“Ó¦²śÉś¾ßÓŠ±¬ÕØŠŌµÄÓŠ¶¾ĘųĢ嵞µŖ»ÆĒā”£ŹµŃéŹŅæÉĄūÓĆŃĒĻõĖįŹå¶”õ„(t£BuNO2£¬ŅŌt£Bu±ķŹ¾Źå¶”»ł)ÓėN2H4”¢ĒāŃõ»ÆÄĘČÜŅŗ»ģŗĻ·“Ó¦ÖʱøµžµŖ»ÆÄĘ”£
(1)ÖʱøŃĒĻõĖįŹå¶”õ„
Č”Ņ»¶ØNaNO2ČÜŅŗÓė50%ĮņĖį»ģŗĻ£¬·¢Éś·“Ó¦H2SO4£«2NaNO2===2HNO2£«Na2SO4”£æÉĄūÓĆŃĒĻõĖįÓėŹå¶”“¼(t£BuOH)ŌŚ40 ”ę×óÓŅÖʱøŃĒĻõĖįŹå¶”õ„£¬ŹŌŠ“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ________________”£
(2)ÖʱøµžµŖ»ÆÄĘ(NaN3)
°“ČēĶ¼ĖłŹ¾×é×°ŅĒĘ÷(¼ÓČČ×°ÖĆĀŌ)½ųŠŠ·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗt£BuNO2£«NaOH£«N2H4===NaN3£«2H2O£«t£BuOH”£

¢Ł×°ÖĆaµÄĆū³ĘŹĒ________________£»
¢ŚøĆ·“Ó¦ŠčæŲÖĘĪĀ¶ČŌŚ65 ”ę£¬²ÉÓƵďµŃé“ėŹ©ŹĒ____________________£»
¢Ū·“Ó¦ŗóČÜŅŗŌŚ0 ”ęĻĀĄäČ“ÖĮÓŠ“óĮ澧ĢåĪö³öŗó¹żĀĖ£¬ĖłµĆ¾§ĢåŹ¹ÓĆĪŽĖ®ŅŅ“¼Ļ“µÓ”£ŹŌ½āŹĶµĶĪĀĻĀ¹żĀĖŗĶŹ¹ÓĆĪŽĖ®ŅŅ“¼Ļ“µÓ¾§ĢåµÄŌŅņŹĒ______________________________________________”£
(3)²śĀŹ¼ĘĖć
¢Ł³ĘČ”2.0 gµžµŖ»ÆÄĘŹŌŃł£¬Åä³É100 mLČÜŅŗ£¬²¢ĮæČ”10.00 mLČÜŅŗӌ׶ŠĪĘæÖŠ”£
¢ŚÓƵĪ¶Ø¹Ü¼ÓČė0.10 mol”¤L£1ĮłĻõĖįīęļ§[(NH4)2Ce(NO3)6]ČÜŅŗ40.00 mL[·¢ÉśµÄ·“Ó¦ĪŖ2(NH4)2Ce(NO3)6£«2NaN3===4NH4NO3£«2Ce(NO3)3£«2NaNO3£«3N2”ü](¼ŁÉčŌÓÖŹ¾ł²»²ĪÓė·“Ó¦)”£
¢Ū³ä·Ö·“Ó¦ŗó½«ČÜŅŗĻ”ŹĶ²¢Ėį»Æ£¬µĪČė2µĪĮŚ·ĘĀŽßųÖøŹ¾Ņŗ£¬²¢ÓĆ0.10 mol”¤L£1ĮņĖįŃĒĢśļ§[(NH4)2Fe(SO4)2]ĪŖ±ź×¼Ņŗ£¬µĪ¶Ø¹żĮæµÄCe4£«£¬ÖÕµćŹ±Ļūŗıź×¼ČÜŅŗ20.00 mL(µĪ¶ØŌĄķ£ŗCe4£«£«Fe2£«===Ce3£«£«Fe3£«)”£¼ĘĖćæÉÖŖµžµŖ»ÆÄʵÄÖŹĮæ·ÖŹżĪŖ__________(±£Įō2Ī»ÓŠŠ§Źż×Ö)”£ČōĘäĖū²Ł×÷¼°¶ĮŹż¾łÕżČ·£¬µĪ¶Øµ½ÖÕµćŗó£¬ĻĀĮŠ²Ł×÷»įµ¼ÖĀĖł²ā¶Øѳʷ֊µžµŖ»ÆÄĘÖŹĮæ·ÖŹżĘ«“óµÄŹĒ______(Ģī×ÖÄø“śŗÅ)”£
A£®×¶ŠĪĘæŹ¹ÓƵžµŖ»ÆÄĘČÜŅŗČóĻ“
B£®µĪ¼ÓĮłĻõĖįīęļ§ČÜŅŗŹ±£¬µĪ¼ÓĒ°ŃöŹÓ¶ĮŹż£¬µĪ¼Óŗóø©ŹÓ¶ĮŹż
C£®µĪ¼ÓĮņĖįŃĒĢśļ§±ź×¼ČÜŅŗŹ±£¬æŖŹ¼Ź±¼ā×ģ“¦ĪŽĘųÅŻ£¬½įŹųŹ±³öĻÖĘųÅŻ
D£®µĪ¶Ø¹ż³ĢÖŠ£¬½«¹ŅŌŚ×¶ŠĪĘæ±ŚÉĻµÄĮņĖįŃĒĢśļ§±ź×¼ŅŗµĪÓĆÕōĮóĖ®³å½ųĘæÄŚ
(4)µžµŖ»ÆÄĘÓŠ¶¾£¬æÉŅŌŹ¹ÓĆ“ĪĀČĖįÄĘČÜŅŗ¶Ōŗ¬ÓŠµžµŖ»ÆÄʵÄČÜŅŗ½ųŠŠĻś»Ł£¬·“Ó¦ŗóČÜŅŗ¼īŠŌĆ÷ĻŌŌöĒ棬ĒŅ²śÉśĪŽÉ«ĪŽĪ¶µÄĪŽ¶¾ĘųĢ壬ŹŌŠ“³ö·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņ¼°Ęä»ÆŗĻĪļÓŠŠķ¶ąÓĆĶ¾£¬Ļą¹ŲĪļÖŹµÄĪļĄķ³£ŹżČēĻĀ±ķĖłŹ¾£ŗ
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
ČŪµć/”ę | 85.5 | 115.2 | >600£Ø·Ö½ā£© | 75.5 | 16.8 | 10.3 |
·Šµć/”ę | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©»łĢ¬FeŌ×Ó¼Ū²ćµē×ӵĵē×ÓÅŲ¼Ķ¼£Ø¹ģµĄ±ķ“ļŹ½£©ĪŖ__________£¬»łĢ¬SŌ×Óµē×ÓÕ¼¾Ż×īøßÄܼ¶µÄµē×ÓŌĘĀÖĄŖĶ¼ĪŖ_________ŠĪ”£
£Ø2£©øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ£¬H2S”¢SO2”¢SO3µÄĘųĢ¬·Ö×ÓÖŠ£¬ÖŠŠÄŌ×Ó¼Ū²ćµē×Ó¶ŌŹż²»Ķ¬ÓŚĘäĖū·Ö×ӵďĒ_________”£
£Ø3£©Ķ¼£Øa£©ĪŖS8µÄ½į¹¹£¬ĘäČŪµćŗĶ·ŠµćŅŖ±Č¶žŃõ»ÆĮņµÄČŪµćŗĶ·Šµćøßŗܶą£¬Ö÷ŅŖŌŅņĪŖ__________”£
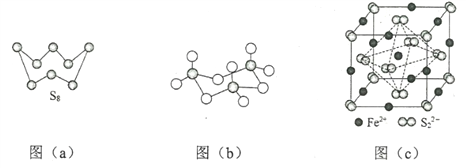
£Ø4£©ĘųĢ¬ČżŃõ»ÆĮņŅŌµ„·Ö×ÓŠĪŹ½“ęŌŚ£¬Ęä·Ö×ÓµÄĮ¢Ģå¹¹ŠĶĪŖ_____ŠĪ£¬ĘäÖŠ¹²¼Ū¼üµÄĄąŠĶÓŠ______ÖÖ£»¹ĢĢåČżŃõ»ÆĮņÖŠ“ęŌŚČēĶ¼£Øb£©ĖłŹ¾µÄČż¾Ū·Ö×Ó£¬øĆ·Ö×ÓÖŠSŌ×ÓµÄŌӻƹģµĄĄąŠĶĪŖ________”£
£Ø5£©FeS2¾§ĢåµÄ¾§°ūČēĶ¼£Øc£©ĖłŹ¾”£¾§°ū±ß³¤ĪŖa nm”¢FeS2Ļą¶ŌŹ½ĮæĪŖM£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬Ę侧ĢåĆÜ¶ČµÄ¼ĘĖć±ķ“ļŹ½ĪŖ___________g”¤cm3£»¾§°ūÖŠFe2+Ī»ÓŚ![]() ĖłŠĪ³ÉµÄÕż°ĖĆęĢåµÄĢåŠÄ£¬øĆÕż°ĖĆęĢåµÄ±ß³¤ĪŖ______nm”£
ĖłŠĪ³ÉµÄÕż°ĖĆęĢåµÄĢåŠÄ£¬øĆÕż°ĖĆęĢåµÄ±ß³¤ĪŖ______nm”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖ£ØN£©”¢Į×£ØP£©”¢Éé£ØAs£©µČ¢õAŌŖĖŲ»ÆŗĻĪļŌŚŃŠ¾æŗĶÉś²śÖŠÓŠÖŲŅŖÓĆĶ¾”£ČēĪŅ¹śæĘŃŠČĖŌ±ŃŠ¾æ·¢ĻÖAs2O3»ņŠ“³ÉAs4O6£¬Ė׳ĘÅųĖŖ£©¶Ō°×ŃŖ²”ÓŠĆ÷ĻŌµÄÖĪĮĘ×÷ÓĆ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AsŌ×ӵļņ»ÆµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ_____£»PµÄµŚŅ»µēĄėÄܱČS“óµÄŌŅņĪŖ________”£
£Ø2£©Š“³öŅ»ÖÖÓėCN-»„ĪŖµČµē×ÓĢåµÄ·Ö×Ó___£ØÓĆ»ÆѧŹ½±ķŹ¾£©£»(SCN)2·Ö×ÓÖŠ¦Ņ¼üŗĶ¦Š¼üøöŹż±ČĪŖ__”£
£Ø3£©ÅųĖŖ¾ē¶¾£¬æÉÓĆŹÆ»ŅĻū¶¾Éś³ÉAsO33-ÉŁĮæAsO43-£¬ĘäÖŠAsO33-ÖŠAsµÄŌӻƷ½Ź½ĪŖ___£¬AsO43-µÄæռ乹ŠĶĪŖ___”£
£Ø4£©NH4+ÖŠH-N-H¼ü½Ē±ČNH3ÖŠH-N-HµÄ¼ü½Ē“óµÄŌŅņŹĒ____£»NH3ŗĶĖ®·Ö×ÓÓėĶĄė×ÓŠĪ³ÉµÄ»ÆŗĻĪļÖŠŃōĄė×Ó³ŹÖįĻņĻĮ³¤µÄ°ĖĆęĢå½į¹¹£ØČēĶ¼¢ń£©£¬øĆ»ÆŗĻĪļ¼ÓČČŹ±Ź×ĻČŹ§Č„Ė®£¬Ēė“ÓŌ×Ó½į¹¹½Ē¶Č¼ÓŅŌ____”£
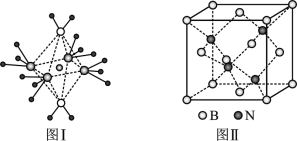
£Ø5£©BNµÄČŪµćĪŖ3000”ę£¬ĆܶČĪŖ2.25g/cm3£¬Ę侧°ū½į¹¹ČēÉĻĶ¼¢ņĖłŹ¾£¬¾§ĢåÖŠŅ»øöBŌ×ÓÖÜĪ§¾ąĄė×ī½üµÄNŌ×ÓÓŠ____øö£»ČōŌ×Ó°ė¾¶·Ö±šĪŖrNŗĶrB£¬°¢·ü¼ÓµĀĀŽ³£ŹżÖµĪŖNA£¬ŌņBN¾§°ūÖŠŌ×ÓµÄĢå»żÕ¼¾§°ūĢå»żµÄ°Ł·ÖĀŹĪŖ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
A. ABnŠĶ·Ö×ÓÖŠ£¬ČōÖŠŠÄŌ×Óƻӊ¹Ā¶Ōµē×Ó£¬ŌņABnĪŖæÕ¼ä¶Ō³Ę½į¹¹£¬ŹōÓŚ·Ē¼«ŠŌ·Ö×Ó
B. Ė®ŗÜĪČ¶ØŹĒŅņĪŖĖ®ÖŠŗ¬ÓŠ“óĮæµÄĒā¼üĖłÖĀ
C. H2O”¢NH3”¢CH4·Ö×ÓÖŠµÄO”¢N”¢C·Ö±šŠĪ³É2øö”¢3øö”¢4øö¼ü£¬¹ŹO”¢N”¢CŌ×Ó·Ö±š²ÉČ”sp”¢sp2”¢sp3ŌÓ»Æ
D. ÅäŗĻĪļ[Cu(H2O)4]SO4ÖŠ£¬ÖŠŠÄĄė×ÓŹĒCu2£«£¬ÅäĪ»ĢåŹĒSO42-
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com