
分析 (1)根据从草木灰中除去不溶性的固体杂质的操作步骤分析;
(2)玻璃棒有搅拌、引流的作用;
(3)①碳酸根离子和盐酸反应产生气体;
②硫酸根离子或是银离子、亚硫酸根离子都可以和氯化钡反应生成白色沉淀;
③氯离子和硝酸酸化的银离子反应生成白色沉淀,据此回答.
解答 解;(1)从草木灰中除去不溶性的固体杂质来提取固体碳酸钾的实验操作顺序为:称量样品;溶解、沉淀;过滤;蒸发结晶.故填:蒸发结晶.
(2)在实验操作过程中,玻璃棒的作用分别是:搅拌,加速样品溶解(助溶);引流,防止滤液溅到漏斗外;搅拌(匀热),使溶液受热均匀,防止滤液飞溅.
故答案为:引流,防止滤液溅到漏斗外;
(3)①碳酸根离子能和盐酸反应生成二氧化碳,向溶液中加入稀盐酸后有气泡生成说明有碳酸根离子;故答案为:气泡;CO32-;
②向原溶液中滴加氯化钡溶液,如果产生白色沉淀,说明溶液中有硫酸根离子或是银离子、亚硫酸根离子中的一种,故答案为:否;能和氯化钡反应产生白色沉淀的可以是子或是银离子、亚硫酸根离子;
③向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有氯离子.
故答案为:向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有氯离子.
点评 本题考查了分离提纯的方法及常见阴离子的检验,难度不大,注意基础知识的积累.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水总是自发地由高处往低处流 | |
| B. | 有序排列的火柴散落时成为无序排列 | |
| C. | 放热反应容易进行,吸热反应不能自发进行 | |
| D. | 多次洗牌以后,扑克牌的毫无规律的混乱排列的几大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用铜粉氧化法生产CuO的流程图:
CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用铜粉氧化法生产CuO的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲验证Na2O2与水的反应为放热反应 | |
| B. | 用装置乙验证铁和水蒸气的反应,方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 | |
| C. | 丙装置,将蘸取氯化钾溶液的铂丝放在酒精灯上灼烧,检验钾元素 | |
| D. | 用装置丁比较碳酸钠和碳酸氢钠的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. +2OH-$\stackrel{△}{→}$
+2OH-$\stackrel{△}{→}$ +CH3OH+H2O.
+CH3OH+H2O. ,该反应类型是缩聚.
,该反应类型是缩聚. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:2NO2(g)═N2O4(g),N2O4为无色气体.
已知:2NO2(g)═N2O4(g),N2O4为无色气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ?
?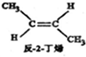 ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com