
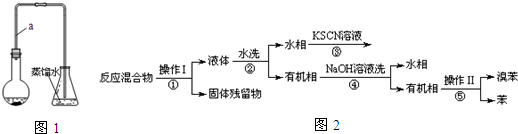
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
 .
. 分析 (1)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(2)反应生成的溴苯和溴互溶呈褐色油状液滴;
Ⅱ.苯及溴在FeBr3催化作用下制备溴苯,反应混合物中含有苯、溴苯、溴、FeBr3以及Fe,由流程可知经操作Ⅰ后得到固体残留物,则操作Ⅰ应为过滤,固体残留物为Fe粉,液体中含有FeBr3、溴等,都可溶于水;经分液后,有机相中含有苯、溴苯、溴,加入氢氧化钠溶液,水相中主要含有NaBr、NaBrO等,有机相中含有苯、溴苯,由于二者沸点不同,可进行蒸馏分离,以此解答(3)(4);
(5)锥形瓶中含有挥发出来的溴单质,干扰了实验的检验;
(6)使混合液分层,需要加入有机溶剂,据此可知①为四氯化碳,由于四氯化碳的密度大于水,则含有离子的溶液在上层,应该取上层溶液;
根据结论“锥形瓶中液体含大量Br-”,则③为氧化剂,溴离子被氧化成溴单质,则根据溴单质有色判断④;
根据现象“有汽泡生成”,则气泡为氢气,⑤应该是加入金属单质,证明了溶液中含有大量氢离子;
通过实验可知,溶液中存在大量的氢离子和溴离子,从而证明了苯与液溴在铁催化下发生取代反应生成溴苯和溴化氢,写出反应的化学方程式.
解答 解:(1)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气、冷凝回流,
故答案为:冷凝回流;
(2)溴苯是无色液体,溴苯中溶有溴而呈褐色,
故答案为:溴苯溶解了过量的溴;
Ⅱ.苯及溴在FeBr3催化作用下制备溴苯,反应混合物中含有苯、溴苯、溴、FeBr3以及Fe,由流程可知经操作Ⅰ后得到固体残留物,则操作Ⅰ应为过滤,固体残留物为Fe粉,液体中含有FeBr3、溴等,都可溶于水,经分液后,有机相中含有苯、溴苯、溴,加入氢氧化钠溶液,水相中主要含有NaBr、NaBrO等,有机相中含有苯、溴苯,由于二者沸点不同,可进行蒸馏分离,以此解答该题.
(3)由以上分析可知操作Ⅰ为过滤,操作Ⅱ为蒸馏,
故答案为:蒸馏;
(4)经“水洗”、“NaOH 溶液洗”后得到水相和有机相,则应为分液操作,除需要烧杯外,还需要分液漏斗;流程③,溶液中含有铁离子,滴加KCSN溶液,溶液变红色;流程④的作用是除去溴苯中混有的溴单质,
故答案为:分液漏斗;溶液变血红色(或红色);除去溴苯中的溴;
(5)由于溴易挥发,锥形瓶中有挥发出来的溴,干扰了溴化氢的检验,故给判断不合理,
故答案为:不合理;
(6)使混合液分层,需要加入有机溶剂,则①为四氯化碳,由于四氯化碳的密度大于水,则含有离子的溶液在上层,有机溶剂在下层,应该取上层溶液,即②为上;
根据结论“锥形瓶中液体含大量Br-”,则③为氧化剂氯水,溴离子被氧化成溴单质,则④为红棕剧哦橙红色;
根据现象“有汽泡生成”,则气泡为氢气,⑤应该是加入金属镁粉,证明了溶液中含有大量氢离子,则锥形瓶中液体含大量⑥H+;
通过实验可知,溶液中存在大量的氢离子和溴离子,从而证明了苯与液溴在铁催化下发生取代反应生成溴苯和溴化氢,反应的化学方程式为: ,
,
故答案为:①四氯化碳(或CCl4);②上; ③氯水; ④红棕(橙红色也可以); ⑤镁粉; ⑥H+;取代; .
.
点评 本题考查了有机合成、性质实验方案的设计,题目难度中等,注意掌握性质实验方案的设计与评价原则,明确化学实验基本操作方法,试题充分考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Y>Z>X | |
| B. | X、Y和Z三种元素形成化合物中一定含有离子键和共价键 | |
| C. | 气态氢化物的稳定性:Z>Y>R | |
| D. | Y的最高价氧化物对应的水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别乙醇、四氯化碳和苯可以用蒸馏水 | |
| B. | 鉴别羊毛织物和棉织物可以用灼烧并闻气味的方法 | |
| C. | 除去乙酸乙酯中含有的乙酸,最好的方法是蒸馏 | |
| D. | 鉴别甲烷、一氧化碳和氢气的方法是:点燃并先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
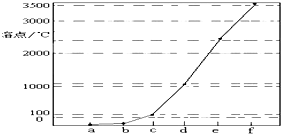 如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
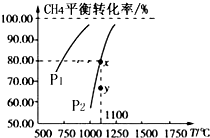 在一恒容的密闭容器中充入0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭容器中充入0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图,下列有关说法不正确的是( )| A. | 此条件下,1molCH4(g)和1molCO2(g)的总能量大于2mol CO(g)和2molH2(g)的总能量 | |
| B. | 压强:P2>P1 | |
| C. | 1100℃达平衡时,c(CO)=0.16 mol/L | |
| D. | 压强为P2时,在y点:v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HSO3- | |
| B. | 加入Al有H2生成的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | NaOH溶液中:K+、Na+、AlO2-、CO32- | |
| D. | NaHCO3溶液中:K+、Al3+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com