
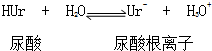
 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
分析 由题目信息可知,关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,说明温度越低,越有利于尿酸钠的形成,降低温度平衡向放热方向移动,据此解答.
解答 解:由题目信息可知,关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,说明温度越低,越有利于尿酸钠的形成,温度降低平衡向正反应进行,降低温度平衡向放热方向移动,故反应②是放热反应,即△H<0,升高温度平衡向逆反应方向移动,所以降低温度平衡向逆反应方向移动,故ABC错误、D正确;
故选D.
点评 以关节炎的病因为载体,考查温度对化学平衡移动的影响,难度不大,考查学生运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
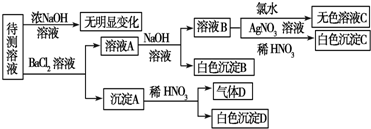
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
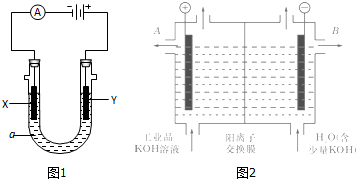
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、W元素的原子半径依次递增 | |
| B. | X、Z、W元素的最高价氧化物的水化物的酸性依次递增 | |
| C. | X、W分别与Y形成化合物在常温下均为气态 | |
| D. | Z、W分别与Y形成的化合物均可作为耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
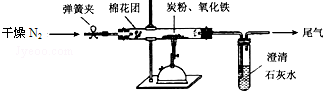
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟单质与水反应的化学方程式为F2+H2O═HF+HFO | |
| B. | 碱金属单质在空气中燃烧的生成物都是过氧化物 | |
| C. | x原子的最外层电子数比y原子的少,能说明金属x比金属y的活泼性强 | |
| D. | HCl气体溶于水的过程中,共价键被破坏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com