
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
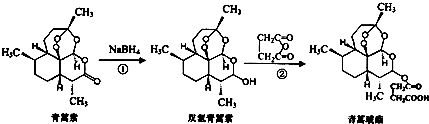
| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素不能与NaOH溶液反应 | |
| C. | 反应②原子利用率为100% | |
| D. | 青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 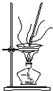 可用于除去碳酸钠固体中含有的少量碳酸氢钠 | |
| B. | 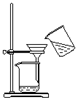 可用于碳酸钙固体和氯化钠溶液的分离 | |
| C. | 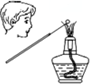 可正确观察钾元素焰色反应 | |
| D. | 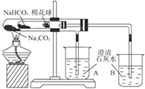 小试管中NaHCO3分解,(B)中澄清石灰水变浑浊,(A)中澄清石灰水没浑浊,说明稳定性Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 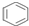 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com