
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O . 分析 由元素在周期表的位置可知,X为Si,Y为O,Z为Cl,
(1)Z为Cl,质子数为17,电子结构有3个电子层,最外层电子数为7;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(3)Y元素的非金属性比S元素的非金属性强,可利用单质之间的置换反应、氢化物稳定性比较;
(4)由信息可知,1mol与Mg2C3水反应生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃为C3H4;
(5)联氨分子含4个N-H键、1个N-N键;H为+1价,N为-2价,满足化合物中正负化合价的代数和为0;用次氯酸钠溶液与氨反应制备联氨,还生成氯化钠和水.
解答 解:由元素在周期表的位置可知,X为Si,Y为O,Z为Cl,
(1)Z为Cl,位于周期表中第三周期、第ⅦA族,故答案为:第三周期、第ⅦA族;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小,则上述元素中Si的原子半径最大,故答案为:Si;
(3)a.Y单质与H2S溶液反应,溶液变浑浊,则Y的得到电子能力强,Y的非金属性强化,故a选;
b.在氧化还原反应中,1molY单质比1molS得电子多,得电子多少不能比较非金属性,故b不选;
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高,可知Y的氢化物稳定,则Y的非金属性强,故c选;
故答案为:ac;
(4)由信息可知,1mol与Mg2C3水反应生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃为C3H4,发生的反应为Mg2C3+4H2O=2 Mg(OH)2+C3H4↑,故答案为:Mg2C3+4H2O=2 Mg(OH)2+C3H4↑;
(5)联氨分子的电子式为 ,其中氮的化合价为为-2价,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O,
,其中氮的化合价为为-2价,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O,
故答案为: ;-2;NaClO+2NH3=N2H4+NaCl+H2O.
;-2;NaClO+2NH3=N2H4+NaCl+H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 金属越活泼金属键越强 | |
| D. | 双原子分子中共价键越强,沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
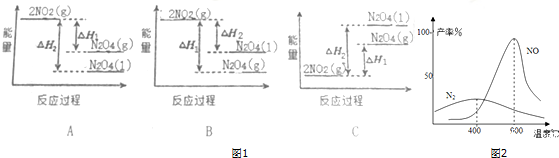
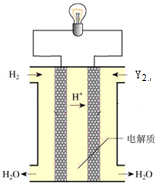
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表的一部分.
如表为元素周期表的一部分.| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯(
苯乙烯(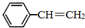 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$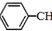 =CH2(g)+H2(g)△=+QkJ.mol-1
=CH2(g)+H2(g)△=+QkJ.mol-1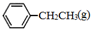 、
、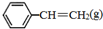 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| 反应物投入量 | 1moN2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
| NH3浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2p1=2p3>p2 | |
| B. | α2+α3<1 | |
| C. | 达到平衡时丙容器中NH3的体积分数最大 | |
| D. | Q1+Q3>92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com