
【题目】下列措施,是为了防止产生雾霾的,其中不可行的是
A. 停止冬季供暖,减少有害物质排放
B. 对锅炉和汽车等产生的有害气体和烟尘等进行处理
C. 退耕还林,改善生态环境
D. 寻找新能源,减少化石燃料的使用
科目:高中化学 来源: 题型:
【题目】氨及铵盐都是重要的化工原料。
I.某兴趣小组制取氨气并探究氨的催化氧化实验。
(1)实验室制取氨气的化学反应方程式为_________________。
(2)如图,分别从A、B两管口通入干燥的氨气和氧气,为保证在装置3中观察到红棕色气体,装置2应装入________;若取消装置2,在装置3中仅观察到大量白烟,原因是______________。
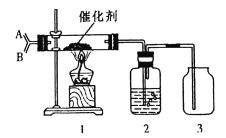
(3)氨气常用于检验化工生产中氯气是否泄漏,因为氯气有少量泄漏时用氨气检验会有白烟生成,同时生成一种对大气无污染的产物,试写出该反应的化学方程式:_________________。
Ⅱ.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)
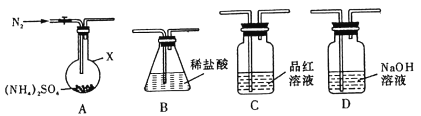
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5 mol/L盐酸70 mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,用0.2 mol/L NaOH溶液中和剩余盐酸,消耗NaOH溶液25 mL。经检验中和后的溶液中无SO42-。
(4)装置B内溶液吸收气体的物质的量是_________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-、无SO42-,进一步研究发现,气体产物中无氮氧化物。
(5)检验装置D内溶液中有SO32-、无SO42-的实验操作和现象是:___________________。
(6) (NH4)2SO4在400℃分解的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D的合成路线如下所示:

请回答下列问题:
(1)上述过程中,由B→C的有机反应类型为_________ ;
(2)C在①银氨溶液中发生反应的化学方程式为____________;
(3)有机物M为D的同分异构体,且知M有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应.试写出M的结构简式___________;
(4)某学生预测A、B、C、D有如下性质,其中正确的是_____________;
①化合物A遇氯化铁溶液呈紫色 ②化合物B能与NaHCO3溶液反应
③1mol化合物C能与3molH2反应 ④1mol化合物D完全燃烧消耗9.5molO2
(5)有机物X(C9H9ClO3)经过化学反应也可制得D,则X在NaOH醇溶液中反应的化学方程式为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 KClO3 + 6HCl(浓)= KCl + 3Cl2 + 3H2O 的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是
A. 1∶5 B. 5∶1 C. 6∶1 D. 1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盐类的水解过程中,下列各种情况必定发生的是( )
A.盐的电离平衡被破坏 B.溶液温度升高
C.25℃,溶液的pH不是7 D.水的电离平衡被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质溶液的燃料电池中发电,电池负极反应式为( )
A.H2+2OH--2e-=2H2O B.H2-2e-=2H+
C.O2+4H++4e- =2H2O D.O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备氯化铵、纯碱、金属镁等物质,其流程如下图所示:
 (1)反应①~⑤中,属于氧化还原反应的是__________(填编号)
(1)反应①~⑤中,属于氧化还原反应的是__________(填编号)
(2)写出反应②的离子方程式_______________
(3)X溶液中的主要阳离子是Na+和___________
(4)已知氨气极易溶于水,实验室可用NH4Cl和Ca(OH)2固体混合加热制取。根据流程原理制取碳酸氢钠固体,下列实验装置正确且能达到实验目的的是_________

A.用装置甲制取氨气
B.用装置乙制取二氧化碳
C.用装置丙制取碳酸氢钠
D.用装置丁分离碳酸氢钠固体与母液
(5)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次滴加过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③______________;④滴加适量盐酸;⑤_____________________(请补全缺少的实验操作)
(6)检验纯碱样品中是否含NaCl,至少应选用的试剂是____________________
(7)电解熔融氯化镁制镁,得到的镁蒸气可在下列哪种气体氛围中冷却(填序号)________________
A.H2 B.CO2 C.O2 D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为______,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是( )
A. KMnO4 B. HNO3 C. Cl2水 D. H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com