
【题目】1,6-己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如下:
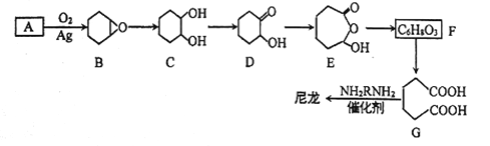
回答下列问题:
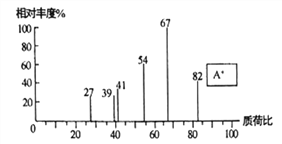
(1)化合物A的质谱图如下,则A的化学名称为_______________。
(2)C→D的反应类型为_____________。
(3)F的结构简式为_________________。
(4)写出能同时满足下列条件的X的同分异构体的结构简式______________。
①相对分子质量与F相等
②烃的含氧衍生物,能发生银镜反应
③核磁共振氢谱中有三组峰,面积比为3:2:1
(5)由G合成尼龙的化学方程式为____________________。
(6)由A通过两步反应制备1,3-环己二烯的合成路线为__________________。
【答案】 环已烯 氧化反应 ![]() OHCCH2C(CH3)2CH2CHO、OHCC(CH2CH3)2CHO
OHCCH2C(CH3)2CH2CHO、OHCC(CH2CH3)2CHO ![]()
【解析】试题分析:由A的质谱图及A到B的转化可知,A为环己烯,由F的分子式及E和G的分子结构可知F为![]() ,最后G与某二胺发生缩聚反应得到尼龙。
,最后G与某二胺发生缩聚反应得到尼龙。
(1)由化合物A的质谱图可知,烃A的相对分子质量为82,A可以氧化为B,则A的化学名称为环己烯。
(2)C→D的反应类型为氧化反应。
(3)F的结构简式为![]() 。
。
(4)①相对分子质量与F相等;②烃的含氧衍生物,能发生银镜反应,说明分子中有醛基;③核磁共振氢谱中有三组峰,面积比为3:2:1。能同时满足这些条件的X的同分异构体有OHCCH2C(CH3)2CH2CHO、OHCC(CH2CH3)2CHO。
(5)由G合成尼龙的化学方程式为![]() 。
。
(6)由A(环己烯)通过两步反应制备1,3-环己二烯,首先将环己烯与溴发生加成反应得到1,2-二溴环己烷,然后1,2-二溴环己烷再发生消去反应即可得到产品。具体合成路线如下: 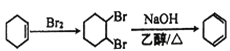 。
。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种烃,其相关信息如下:
A ①完全燃烧的产物中n(CO2):n(H2O)=2:1
②28<M (A)<60
③不能使溴的四氯化碳溶液褪色④一氯代物只有一种结构
B ①饱和链烃,通常情况下呈气态②有同分异构体
③二溴代物有三种
回答下列问题:
(1)烃A的实验式是 ;
(2)烃A的结构简式是 ;
(3)烃B的三种二溴代物的结构简式为 、 、 ;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为 (填一种即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。

(1)请写出E的电子式_______________。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②:________________________ 反应类型________。
反应③:________________________ 反应类型________。
反应④:____________________反应类型________。
反应⑤:____________________反应类型________。
(3)比较反应①剧烈程度_____________(填>、= 或<)钠和水反应的剧烈程度。
Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:

它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素” 的分子式是C12H10O5 D.“亮菌甲素”分子中含氧官能团只有2种
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式_______________________________。
(3)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
乙醇水蒸气重整制氢的部分反应过程如下左图所示:
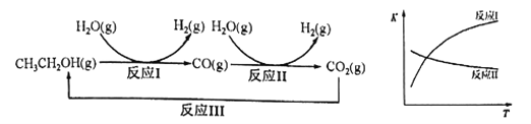
已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如上右图所示。
(1)反应Ⅰ中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ。反应1的热化学方程式是_____________________。
(2)反应Ⅱ,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
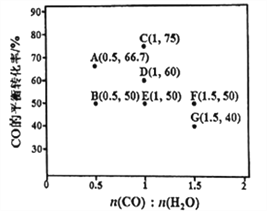
①图中D、E两点对应的反应温度分别为TD和TE判断:TD_______TE (填“<”“=”或“>”)。
②经分析,A、E 和G 三点对应的反应温度相同,其原因是A、E和G三点对应的________相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系
是_________________。
(3)反应Ⅲ,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
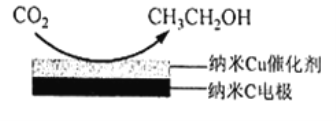
①阴极的电极反应式是____________________。
②从电解后溶液中分离出乙醇的操作方法是_________________。
③直接向KOH溶液中通入CO2,可以获得“经CO2饱和处理的KHCO3电解液”,该过程中浓度先增大后减小的离子是__________________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2=NaBO2 +6H2O,有关的说法不正确的是

A. 纳米MnO2层的作用是提高原电池的工作效率
B. 放电过程中,Na+从B极区移向A极区
C. 电池负极的电极反应为:BH4 +8OH- - 8e一 =BO2-+6H2O
D. 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验结论正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
D | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3 |
A. A B. B C. C D. D
【答案】B
【解析】
白色沉淀可能为AgCl;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫;先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入具有氧化性的氯水,溶液变成红色,说明原溶液中一定存在亚铁离子;能使品红褪色的气体不一定为SO2;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫。
白色沉淀也可能为AgCl,若先加盐酸排除干扰,不生成沉淀,再加氯化钡生成沉淀,则溶液中一定含有SO42-,A错误;向某溶液中加入2滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子;再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后溶液中出现了铁离子,证明原溶液中一定含有Fe2+,B正确;能使品红褪色的气体不一定为SO2,也可能为其它强氧化性气体,如氯气、臭氧等,C错误;产生的气体能使澄清石灰水变浑浊,气体可能为二氧化碳或二氧化硫,则溶液中可能含有CO32-、HCO3-,或SO32-、HSO3-,D错误。
【点睛】
本题考查化学实验方案的评价,侧重分析与实验能力的考查,注意实验的评价性分析,把握常见离子的检验、物质的性质、气体的检验等为解答的关键。
【题型】单选题
【结束】
17
【题目】在铜与浓硫酸的反应中,如果转移0.4mol电子,则被还原的硫酸物质的量
A. 0.4mol B. 0.2mol
C. 小于0.4mol D. 小于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法不正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为________________________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
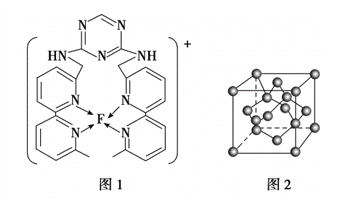
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com