
下列有关说法正确的是 ( )
A.活化分子的总数越多,反应速率越快
B.升高温度,活化分子百分数不变,活化分子数增多,化学反应速率增大
C.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大
D.加入反应物,使活化分子百分数增大,化学反应速率增大
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
某无色气体,可能含HCl、CO2 、NO2 、HI、SO2 、HBr的一种或几种。将其通人氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出 现白色沉淀,另一份加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A.一定存在HCl B.一定存在SO2
C.肯定没有CO2 D.不能肯定是否含有NO2、HI
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
近两年来,“雾霾”一直是人们所关注的对象,下图为雾霾的主要成分示意图。下列说法不正确的是( )
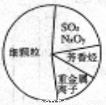
A.SO2和NxOy溶于水均只生成酸
B.重金属离子可导致蛋白质变性
C.苯是最简单的芳香烃
D.大量燃烧化石燃料时造成雾霾天气的一种重要因素
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
COCl2(g)  CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温;②恒压通入惰性气体;③增加CO的浓度;④加催化剂;⑤减压;⑥恒容通入惰性气体。能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温;②恒压通入惰性气体;③增加CO的浓度;④加催化剂;⑤减压;⑥恒容通入惰性气体。能提高COCl2转化率的是
A.①④⑥ B.①②⑤ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列对化学平衡移动的分析中,不正确的是 ( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率减小③有气体参加的反应平衡时,若减小反应器容积时,平衡向气体体积增大的方向移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率减小③有气体参加的反应平衡时,若减小反应器容积时,平衡向气体体积增大的方向移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①③④ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO32-、SO42-、AlO2-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除__________的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除____ __的存在。
(3)另取出部分溶液逐滴加入NaOH溶液,使溶液由酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除________的存在。
(4)取出部分(3)中的碱性溶液加入Na2CO3溶液,有白色沉淀生成,证明有________的存在,可以排除_____的存在。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
分类是学习和研究化学的一种重要方法,下列分类合理的是
A.K2CO3和K2O都属于盐 B.H2SO4和HNO3都属于酸
C.KOH和Na2CO3都属于碱 D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:填空题
[化学——物质结构与性质](13分)
物质结构理论有助于人们研究化学反应规律。请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有 种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途。
①铜原子价电子排布式为
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为 。该化合物阴离子的化学式为 ;
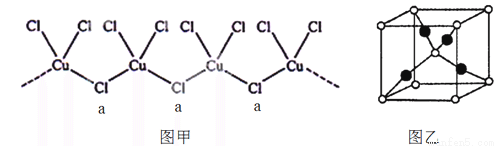
③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 。
A.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键
B.NH3分子的键角小于H2O分子的键角
C.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键
D.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如右图乙所示。A的化学式为 ,晶胞中的白点代表的原子是 (填元素名称)。
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:实验题
(16分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3?5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3?5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示产品发黄的原因 。
II.测定产品纯度准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol?L?1碘的标准溶液滴定。反应原理为:2S2O32?+I2=S4O62-+2I?
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3?5H2O相对分子质量为M) 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com