
”¾ĢāÄæ”æ±½·ÓŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®ŅŌ±½·ÓĪŖÖ÷ŅŖĘšŹ¼ŌĮĻ£¬¾ĻĀĮŠ·“Ó¦æÉÖʵĆĻćĮĻMŗĶøß·Ö×Ó»ÆŗĻĪļN£®£Ø²æ·Ö²śĪļ¼°·“Ó¦Ģõ¼žŅŃĀŌČ„£©
£Ø1£©Óɱ½·ÓÉś³ÉAµÄ»Æѧ·½³ĢŹ½ŹĒ £®
£Ø2£©ŅŃÖŖCµÄ·Ö×ÓŹ½ĪŖC5H12O£¬CÄÜÓė½šŹōNa·“Ó¦£¬CµÄŅ»ĀČ“śĪļÓŠ2ÖÖ£¬ÓėCŗ¬ÓŠĻąĶ¬¹ŁÄÜĶŵÄĶ¬·ÖŅģ¹¹¹²ÓŠÖÖ£¬CµÄ½į¹¹¼ņŹ½ŹĒ£»
£Ø3£©BÓėC·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ £®
£Ø4£©Óɱ½·ÓÉś³ÉDµÄ»Æѧ·½³ĢŹ½ŹĒÓÉDÉś³ÉNµÄ·“Ó¦ĄąŠĶŹĒ
£Ø5£©ŅŌ±½·ÓĪŖ»ł“”ŌĮĻŅ²æÉŅŌŗĻ³É·ĄøƼĮF£®¾ÖŹĘ×·ÖĪöFµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ152£¬ĘäÖŠŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ31%£¬FĶźČ«Č¼ÉÕֻɜ³ÉCO2ŗĶH2O£®ŌņFµÄ·Ö×ÓŹ½ŹĒ £® ŅŃÖŖ£ŗ¢Ł·¼Ļć×å»ÆŗĻĪļFÄÜÓėNaHCO3ČÜŅŗ·“Ó¦£¬ĒŅ²»ÄÜ·¢ÉśĖ®½ā·“Ó¦£»
¢ŚFµÄŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾Ęä·Ö×ÓÖŠŗ¬ÓŠ4ÖÖĒāŌ×Ó£»
¢Ū·Ö×Ó½į¹¹ÖŠ²»“ęŌŚ”°©O©O©”±µÄĮ¬½Ó·½Ź½£®FµÄ½į¹¹¼ņŹ½ŹĒ £®
”¾“š°ø”æ
£Ø1£©![]() +NaOH”ś
+NaOH”ś ![]() +H2O
+H2O
£Ø2£©7£»![]()
£Ø3£©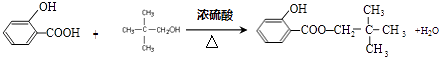
£Ø4£©2 ![]() +
+ ![]()
![]() ?
?  +H2O£»¾Ū·“Ó¦
+H2O£»¾Ū·“Ó¦
£Ø5£©C8H8O3£»![]()
”¾½āĪö”æ½ā£ŗ±½·ÓÓėĒāŃõ»ÆÄĘ·“Ӧɜ³É±½·ÓÄĘ£¬¹ŹAĪŖ ![]() £¬ÓÉ×Ŗ»Æ¹ŲĻµæÉÖŖBĪŖ
£¬ÓÉ×Ŗ»Æ¹ŲĻµæÉÖŖBĪŖ ![]() £¬CµÄ·Ö×ÓŹ½ĪŖC5H12O£¬CÄÜÓė½šŹōNa·“Ó¦£¬ŹōÓŚ±„ŗĶŅ»ŌŖ“¼£¬CµÄŅ»ĀČ“śĪļÓŠ2ÖÖ£¬·Ö×ÓÖŠÓŠ2ÖÖHŌ×Ó£¬¹ŹCµÄ½į¹¹¼ņŹ½ŹĒ
£¬CµÄ·Ö×ÓŹ½ĪŖC5H12O£¬CÄÜÓė½šŹōNa·“Ó¦£¬ŹōÓŚ±„ŗĶŅ»ŌŖ“¼£¬CµÄŅ»ĀČ“śĪļÓŠ2ÖÖ£¬·Ö×ÓÖŠÓŠ2ÖÖHŌ×Ó£¬¹ŹCµÄ½į¹¹¼ņŹ½ŹĒ ![]() £¬BÓėC·¢Éśõ„»Æ·“Ӧɜ³ÉM£¬ŌņMĪŖ
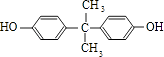
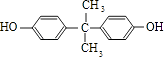
£¬BÓėC·¢Éśõ„»Æ·“Ӧɜ³ÉM£¬ŌņMĪŖ 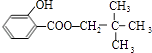 £®±½·ÓÓė±ūĶŖ·“Ӧɜ³ÉD£¬DµÄ·Ö×ÓŹ½ĪŖC15H16O2 £¬ ŌŁ½įŗĻNµÄ½į¹¹æÉÖŖDĪŖ
£®±½·ÓÓė±ūĶŖ·“Ӧɜ³ÉD£¬DµÄ·Ö×ÓŹ½ĪŖC15H16O2 £¬ ŌŁ½įŗĻNµÄ½į¹¹æÉÖŖDĪŖ 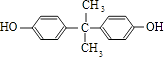 £®£Ø1£©±½·ÓÓėĒāŃõ»ÆÄĘ·“Ӧɜ³É±½·ÓÄĘ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
£®£Ø1£©±½·ÓÓėĒāŃõ»ÆÄĘ·“Ӧɜ³É±½·ÓÄĘ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ ![]() +NaOH”ś
+NaOH”ś ![]() +H2O£¬ĖłŅŌ“š°øŹĒ£ŗ
+H2O£¬ĖłŅŌ“š°øŹĒ£ŗ ![]() +NaOH”ś
+NaOH”ś ![]() +H2O£»£Ø2£©CµÄ½į¹¹¼ņŹ½ŹĒ
+H2O£»£Ø2£©CµÄ½į¹¹¼ņŹ½ŹĒ ![]() £¬ÓėCŗ¬ÓŠĻąĶ¬¹ŁÄÜĶŵÄĶ¬·ÖŅģ¹¹£¬æÉŅŌæ“×÷ĪģĶé±»ōĒ»łČ”“ś£¬ÕżĪģĶé±»ōĒ»łČ”“śÓŠ3ÖÖ£¬ŅģĪģĶé±»ōĒ»łČ”“śÓŠ4ÖÖ£¬ŠĀĪģĶé±»ōĒ»łČ”“śµĆµ½C£¬²»ŗ¬C¹²ÓŠ7ÖÖ£¬ĖłŅŌ“š°øŹĒ£ŗ7£»
£¬ÓėCŗ¬ÓŠĻąĶ¬¹ŁÄÜĶŵÄĶ¬·ÖŅģ¹¹£¬æÉŅŌæ“×÷ĪģĶé±»ōĒ»łČ”“ś£¬ÕżĪģĶé±»ōĒ»łČ”“śÓŠ3ÖÖ£¬ŅģĪģĶé±»ōĒ»łČ”“śÓŠ4ÖÖ£¬ŠĀĪģĶé±»ōĒ»łČ”“śµĆµ½C£¬²»ŗ¬C¹²ÓŠ7ÖÖ£¬ĖłŅŌ“š°øŹĒ£ŗ7£» ![]() £»£Ø3£©BÓėC·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ£ŗ
£»£Ø3£©BÓėC·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ£ŗ 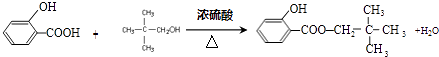 £¬ĖłŅŌ“š°øŹĒ£ŗ
£¬ĖłŅŌ“š°øŹĒ£ŗ  £»£Ø4£©Óɱ½·ÓÉś³ÉDµÄ»Æѧ·½³ĢŹ½ŹĒ£ŗ2
£»£Ø4£©Óɱ½·ÓÉś³ÉDµÄ»Æѧ·½³ĢŹ½ŹĒ£ŗ2 ![]() +
+ ![]()
![]()
 +H2O£»Éś³ÉNµÄ·“Ó¦ĄąŠĶŹĒĖõ¾Ū·“Ó¦ ĖłŅŌ“š°øŹĒ£ŗ2
+H2O£»Éś³ÉNµÄ·“Ó¦ĄąŠĶŹĒĖõ¾Ū·“Ó¦ ĖłŅŌ“š°øŹĒ£ŗ2 ![]() +
+ ![]()
![]()
 +H2O£»Ėõ¾Ū·“Ó¦£»£Ø5£©ŅŌ±½·ÓĪŖ»ł“”ŌĮĻŅ²æÉŅŌŗĻ³É·ĄøƼĮF£®¾ÖŹĘ×·ÖĪöFµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ152£¬ĘäÖŠŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ31%£¬Ōņ·Ö×ÓÖŠŃõŌ×ÓŹżÄæĪŖ
+H2O£»Ėõ¾Ū·“Ó¦£»£Ø5£©ŅŌ±½·ÓĪŖ»ł“”ŌĮĻŅ²æÉŅŌŗĻ³É·ĄøƼĮF£®¾ÖŹĘ×·ÖĪöFµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ152£¬ĘäÖŠŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ31%£¬Ōņ·Ö×ÓÖŠŃõŌ×ÓŹżÄæĪŖ ![]() =3£¬·¼Ļć×å»ÆŗĻĪļFÄÜÓėNaHCO3ČÜŅŗ·“Ó¦£¬ĒŅ²»ÄÜ·¢ÉśĖ®½ā·“Ó¦£¬¹Ź·Ö×ÓÖŠŗ¬ÓŠ±½»·”¢©COOH£¬¼Ł¶ØĪŖ¶žŌŖČ”“ś£¬ŌņŹ£Óą»łĶŵÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ152©76©45=31£¬ĒŅŗ¬ÓŠ1øöOŌ×Ó£¬ĶźČ«Č¼ÉÕֻɜ³ÉCO2ŗĶH2O£¬¹ŹŹ£Óą»łĶÅĪŖ©OCH3»ņ©CH2OH£¬¹ŹFµÄ·Ö×ÓŹ½ĪŖC8H8O3 £¬ FµÄŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾Ęä·Ö×ÓÖŠŗ¬ÓŠ4ÖÖĒāŌ×Ó£¬·Ö×Ó½į¹¹ÖŠ²»“ęŌŚ”°©O©O©”±µÄĮ¬½Ó·½Ź½£¬FµÄ½į¹¹¼ņŹ½ŹĒ
=3£¬·¼Ļć×å»ÆŗĻĪļFÄÜÓėNaHCO3ČÜŅŗ·“Ó¦£¬ĒŅ²»ÄÜ·¢ÉśĖ®½ā·“Ó¦£¬¹Ź·Ö×ÓÖŠŗ¬ÓŠ±½»·”¢©COOH£¬¼Ł¶ØĪŖ¶žŌŖČ”“ś£¬ŌņŹ£Óą»łĶŵÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ152©76©45=31£¬ĒŅŗ¬ÓŠ1øöOŌ×Ó£¬ĶźČ«Č¼ÉÕֻɜ³ÉCO2ŗĶH2O£¬¹ŹŹ£Óą»łĶÅĪŖ©OCH3»ņ©CH2OH£¬¹ŹFµÄ·Ö×ÓŹ½ĪŖC8H8O3 £¬ FµÄŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾Ęä·Ö×ÓÖŠŗ¬ÓŠ4ÖÖĒāŌ×Ó£¬·Ö×Ó½į¹¹ÖŠ²»“ęŌŚ”°©O©O©”±µÄĮ¬½Ó·½Ź½£¬FµÄ½į¹¹¼ņŹ½ŹĒ ![]() £¬ĖłŅŌ“š°øŹĒ£ŗC8H8O3 £¬
£¬ĖłŅŌ“š°øŹĒ£ŗC8H8O3 £¬ ![]() £®
£®


 Č«ÄܲāæŲĘŚÄ©Š”דŌŖĻµĮŠ“š°ø
Č«ÄܲāæŲĘŚÄ©Š”דŌŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
A.Ö½²ćĪöŹĒÉ«Ę×·ÖĪö·ØµÄŅ»ÖÖ£¬æÉÓĆÓŚ·ÖĄė½į¹¹Ļą½ü”¢ŠŌÖŹĻą²ī½ĻĆ÷ĻŌµÄĪļÖŹ
B.µē½ā¾«Į¶”¢½į¾§”¢¼ÓČȵȷ½·ØŹĒ·ÖĄė”¢Ģį“æ¹ĢĢåѳʷµÄ»ł±¾·½·Ø
C.ÓĆ²£Į§°ō½Į¶Æ»ņĶ¶Čė¼øĮ£¾§ĢåŹĒĘĘ»µČÜŅŗ·¢Éś¹ż±„ŗĶĻÖĻóµÄ³£ÓĆ·½·Ø
D.ĪüĀĖ½ö½öÄܼÓæģ¹żĀĖĖŁ¶ČŗĶµĆµ½øüøÉŌļµÄ³Įµķ£¬µ«²»ÄÜŹ¹³ĮµķæÅĮ£±ä“Ö±ä“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A.¹śĒģ70ÖÜÄź“óµä·Å·ÉµÄĘųĒņÓÉæɽµ½ā²ÄĮĻÖĘ³É£¬Ö÷ŅŖ³É·ÖŹĒ¾ŪŅŅĻ©
B.¼ß- 20ÉĻÓƵ½µÄµŖ»ÆļŲ²ÄĮĻŹĒŅ»ÖÖ½šŹōŗĻ½š²ÄĮĻ
C.ĪŅ¹ś·¢ÉäµÄ”°ęĻ¶šČżŗÅ”±ĪĄŠĒĖłŹ¹ÓƵÄĢ¼ĻĖĪ¬£¬ŹĒŅ»ÖÖĪŽ»ś·Ē½šŹō²ÄĮĻ
D.”°ĀĢĖ®ĒąÉ½¾ĶŹĒ½šÉ½Ņųɽ”±”£ĶĘ¹ć¾ŪĀČŅŅĻ©“śĢęľ²Ä£¬Éś²śæģ²ĶŗŠµČ£¬ŅŌ¼õÉŁŹõ²ÄµÄŹ¹ÓĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»ČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÄŚ¼ÓČė0.2molµÄN2ŗĶ0.6molµÄH2 £¬ ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©2NH3£Øg £©”÷H£¼0£¬·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆµÄĒéæöČēĶ¼£ŗ 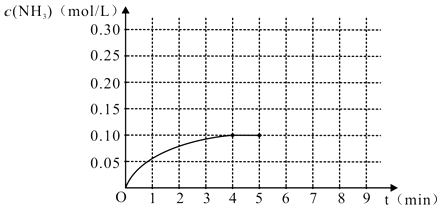
£Ø1£©øł¾ŻÉĻĶ¼£¬¼ĘĖć“Ó·“Ó¦æŖŹ¼µ½Ę½ŗāŹ±£¬Ę½¾ł·“Ó¦ĖŁĀŹv£ØNH3£©ĪŖ £®
£Ø2£©·“Ó¦“ļµ½Ę½ŗāŗ󣬵Ś5·ÖÖÓÄ©£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬Čōøı䷓ӦĪĀ¶Č£¬ŌņNH3µÄĪļÖŹµÄĮæÅØ¶Č²»æÉÄÜĪŖ £®
A.0.20mol/L
B.0.12mol/L
C.0.10mol/L
D.0.08mol/L
£Ø3£©·“Ó¦“ļµ½Ę½ŗāŗ󣬵Ś5·ÖÖÓÄ©£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ČōÖ»°ŃČŻĘ÷µÄĢå»żĖõŠ”Ņ»°ė£¬Ę½ŗāŅĘ¶Æ£ØĢī”°ĻņÄę·“Ó¦·½Ļņ”±”¢”°ĻņÕż·“Ó¦·½Ļņ”±»ņ”°²»”±£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æļ®ŌŖĖŲ±»ÓžĪŖ”°ÄÜŌ“ŌŖĖŲ”±£®ļ®¼°ļ®ŃĪ¾ßÓŠµÄÓÅŅģŠŌÄÜŗĶĢŲŹā¹¦ÄÜ£¬ŌŚ»Æ¹¤”¢µē×Ó”¢Óīŗ½”¢ŗĖÄÜ”¢ÄÜŌ“µČĮģÓņ¶¼µĆµ½¹ć·ŗÓ¦ÓĆ£®
£Ø1£©¢ńļ®µÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ£»ļ®±©Ā¶ŌŚŹŖæÕĘųÖŠŹ±£¬»įŃøĖŁµŲŹ§Č„½šŹō¹āŌ󔢱ķĆęæŖŹ¼±äŗŚ£¬øü³¤Ź±¼äŌņ±ä³É°×É«£®Éś³ÉµÄ»ÆŗĻĪļŹĒµŖ»Æļ®”¢ĒāŃõ»Æļ®£¬×īÖÕÉś³ÉĢ¼Ėįļ®£®Š“³öÉś³ÉµŖ»Æļ®µÄ»Æѧ·½³ĢŹ½ £®
£Ø2£©¢ņĻĀĆęŹĒ“Óļ®»ŌŹÆ£ØLi2OAl2O3SiO2£©ÖŠĢį³öļ®µÄ¹¤ŅµĮ÷³ĢŹ¾ŅāĶ¼£®
¢ŁøßĪĀģŃÉÕŹ±µÄ·“Ó¦ŌĄķĪŖ£ŗ
Li2OAl2O3SiO2+K2SO4ØTK2OAl2O3SiO2+Li2SO4
Li2OAl2O3SiO2+Na2SO4ØTNa2OAl2O3SiO2+Li2SO4
¢Śļ®Ąė×Ó½žČ”ŅŗÖŠŗ¬ÓŠµÄ½šŹōĄė×ÓĪŖ£ŗK+”¢Na+”¢Li+”¢Fe3+”¢Fe2+”¢Al3+”¢Mn2+ £®
¢Ū¼øÖÖ½šŹōĄė×Ó³ĮµķĶźČ«µÄpH
½šŹōĄė×Ó | Al£ØOH£©3 | Fe£ØOH£©2 | Fe£ØOH£©3 | Mn£ØOH£©2 |
³ĮµķĶźČ«µÄpH | 4.7 | 9.0 | 3.2 | 10.1 |
¢ÜLi2SO4”¢Li2CO3ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄČܽā¶Č£Øg/100gĖ®£©
ĪĀ¶Č | 10”ę | 20”ę | 50”ę | 80”ę |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
a.½žČ”Ź±Ź¹ÓĆĄäĖ®µÄŌŅņŹĒ £®
b.ĀĖŌü2µÄÖ÷ŅŖ³É·ÖĪŖ £®
c.Į÷³ĢÖŠ·Ö2“Īµ÷½ŚpH£ØpH7”«8ŗĶpH£¾13£©£¬ÓŠŃŠ¾æÕß³¢ŹŌÖ»¼ÓŅ»“ĪÅØNaOHČÜŅŗŹ¹pH£¾13£¬½į¹ū·¢ĻÖŌŚ¼Ó±„ŗĶĢ¼ĖįÄĘČÜŅŗ³Įļ®ŗó£¬Ėę×Å·ÅÖĆŹ±¼äŃÓ³¤£¬°×É«³ĮµķŌö¼Ó£¬×īŗóµĆµ½µÄLi2CO3²śĘ·ÖŠŌÓÖŹŌö¶ą£®Li2CO3²śĘ·ÖŠµÄŌÓÖŹæÉÄÜŹĒ £¬ ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾Ęä²śÉśµÄŌŅņ £®
d.¼ÓČČÅØĖõµÄ×÷ÓĆŹĒ £®
e.Ļ“µÓLi2CO3¾§ĢåŹ¹ÓĆ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éĢ½¾æÅØ”¢Ļ”ĻõĖįŃõ»ÆŠŌµÄĻą¶ŌĒæČõ£¬°“ĻĀĶ¼×°ÖĆ½ųŠŠŹŌŃé£Ø¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£©”£ŹµŃé±ķĆ÷ÅØĻõĖįÄܽ«NOŃõ»Æ³ÉNO2£¬¶ųĻ”ĻõĖį²»ÄÜŃõ»ÆNO”£ÓÉ“ĖµĆ³öµÄ½įĀŪŹĒÅØĻõĖįµÄŃõ»ÆŠŌĒæÓŚĻ”ĻõĖį”£

æÉŃ”Ņ©Ę·£ŗÅØĻõĖį”¢3mol/LĻ”ĻõĖį”¢ÕōĮóĖ®”¢ÅØĮņĖį”¢ĒāŃõ»ÆÄĘČÜŅŗ¼°¶žŃõ»ÆĢ¼
ŅŃÖŖ£ŗĒāŃõ»ÆÄĘČÜŅŗ²»ÓėNO·“Ó¦£¬ÄÜÓėNO2·“Ó¦![]()
£Ø1£©×°ÖĆ¢ŁÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ__________
£Ø2£©µĪ¼ÓÅØĻõĖįÖ®Ē°µÄ²Ł×÷ŹĒ¼ģŃé×°ÖƵÄĘųĆÜŠŌ£¬¼ÓČėŅ©Ę·£¬“ņæŖµÆ»É¼ŠĶØČė_________ĘųĢå£ØĢī»ÆѧŹ½£©Ņ»¶ĪŹ±¼ä£¬¹Ų±ÕµÆ»É¼Š£¬½«×°ÖĆ¢ŻÖŠµ¼¹ÜÄ©¶ĖÉģČėµ¹ÖƵÄÉÕĘæÄŚ”£
£Ø3£©ŹµŃéÓ¦±ÜĆāÓŠŗ¦ĘųĢåÅŷŵ½æÕĘųÖŠ£¬×°ÖĆ¢ŪÖŠŹ¢·ÅµÄŅ©Ę·ŹĒ_________£»×°ÖĆ¢ŽÖŠŹ¢·ÅµÄŅ©Ę·ŹĒ_________”£
£Ø4£©×°ÖĆ¢ŚÖŠŹ¢·ÅµÄŅ©Ę·ŹĒ_________£»øĆ×°ÖƵÄ×÷ÓĆŹĒ_______________________”£
£Ø5£©øĆŠ”×éµĆ³öµÄ½įĀŪĖłŅĄ¾ŻµÄŹŌŃéĻÖĻóŹĒ__________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚŃõ»Æ»¹Ō·“Ó¦µÄŠšŹöÕżČ·µÄŹĒ£Ø £©
A£®ŌŚ·“Ó¦ÖŠ²»Ņ»¶ØĖłÓŠŌŖĖŲµÄ»ÆŗĻ¼Ū¶¼·¢Éś±ä»Æ
B£®æĻ¶ØÓŠŅ»ÖÖŌŖĖŲ±»Ńõ»Æ£¬ĮķŅ»ÖÖŌŖĖŲ±»»¹Ō
C£®·Ē½šŹōµ„ÖŹŌŚ·“Ó¦ÖŠÖ»×÷Ńõ»Æ¼Į
D£®½šŹōŌ×ÓŹ§µē×ÓŌ½¶ą£¬Ę仹ŌŠŌŌ½Ēæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖŹµĻÖ”°ĀĢÉ«°ĀŌĖ”±£¬ĻĀĮŠ½ØŅé²»ŗĻĄķµÄŹĒ£Ø £©
A.ĶĘ¹ćŹ¹ÓĆĪŽĮ×Ļ“µÓ¼Į
B.ĶĘ¹ćĄ¬»ų·ÖĄą“ę·Å”¢»ŲŹÕŗĶ“¦Ąķ
C.Ģį³«Ź¹ÓĆŹÖÅĮ£¬¼õÉŁ²Ķ½ķÖ½µÄŹ¹ÓĆ
D.Ģį³«Ź¹ÓĆŅ»“ĪŠŌĖÜĮĻ²Ķ¾ßŗĶĖÜĮĻ“ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹ·¢Éś±ä»ÆŹ±£¬ĖłæĖ·žµÄĮ£×Ó¼äĻą»„×÷ÓĆŹōÓŚĶ¬ÖÖĄąŠĶµÄŹĒ£Ø £©
A.ŅŗäåŗĶ±½·Ö±šŹÜČȱäĪŖĘųĢå
B.øɱłŗĶĀČ»Æļ§·Ö±šŹÜČȱäĪŖĘųĢå
C.¶žŃõ»Æ¹čŗĶĢś·Ö±šŹÜČČČŪ»Æ
D.Ź³ŃĪŗĶĘĻĢŃĢĒ·Ö±šČܽāŌŚĖ®ÖŠ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com