
| 类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
| A | CO2 | CuO | 氨气 | NH3•H2O | 葡萄糖 |
| B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
| C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
| D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 酸性氧化物是指能和碱反应生成盐和水的氧化物;
碱性氧化物是指能和酸反应生成盐和水的氧化物;
电解质是在水溶液中或熔融状态下能导电的化合物;
强电解质是指在水溶液中能完全电离的电解质;
高分子物质是指相对分子质量很大的物质,一般相对分子质量需要在几千或以上.
解答 解:A、氨气不是电解质,是非电解质;NH3•H2O是水溶液中只能部分电离,是弱电解质;葡萄糖相对分子质量很小,不是高分子化合物,故A错误;
B、稀硫酸是溶液,是混合物,不是电解质;果糖相对分子质量很小,不是高分子化合物,故B错误;
C、SO2是酸性氧化物;CaO是碱性氧化物;冰醋酸是酸,是电解质;KOH是强电解质;纤维素是高分子化合物,故C正确;
D、Na2O2不是碱性氧化物;Cu(OH)2是弱碱,是弱电解质,故D错误.
故选C.
点评 本题考查了酸性氧化物、碱性氧化物、电解质、强电解质和高分子化合物的辨别,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
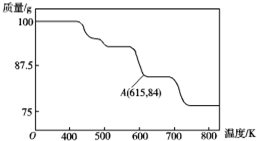 铬(Cr)有许多种化合物,在工业生产中有广泛的用途.
铬(Cr)有许多种化合物,在工业生产中有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+ | B. | 热稳定性:HCl>HF | ||
| C. | 酸性:H3BO3>H2CO3 | D. | 碱性:Al(OH)3>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
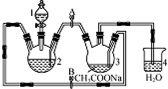 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应.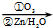 RCHO+R′CHO
RCHO+R′CHO .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除④⑦外 | B. | 除③⑥外 | C. | ①②⑤ | D. | 除④外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | 催化剂 | 温度 | |
| A | 10mL20% H2O2溶液 | 无 | 40℃ |
| B | 10mL20% H2O2溶液 | 无 | 25℃ |
| C | 10mL20% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 | 40℃ |
| D | 10mL10% H2O2溶液 | 无 | 25℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
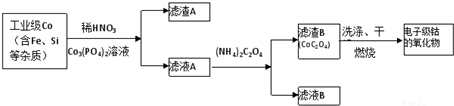
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com