
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
分析 A、常温常压下,水为液态;
B、溶液体积不明确;
C、浓HNO3与铜反应被还原为NO2,稀HNO3与铜反应被还原为NO;
D、根据CH4和C2H4均含4个氢原子来分析.
解答 解:A、常温常压下,水为液态,故22.4L水的物质的量不是1mol,所含的极性共价键的物质的量不是2mol,故A错误;
B、溶液体积不明确,故溶液中NH4+的数目无法计算,故B错误;
C、由于浓HNO3与铜反应被还原为NO2,而稀HNO3与铜反应被还原为NO,100 mL 12 mol•L-1的浓HNO3中被还原为NO2和NO的物质的量不明确,故转移的电子数无法计算,故C错误;
D、标况下,11.2L混合气体的物质的量为0.5mol,而CH4和C2H4均含4个氢原子,故0.5mol混合气体中含有的氢原子的物质的量为2mol,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子电子层结构为1s22s1 | B. | Y为ⅡA族元素,其元素符号为Mg | ||
| C. | Z的价电子数为1 | D. | X的原子半径小于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 结合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①与②溶液等体积混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
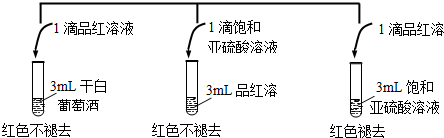
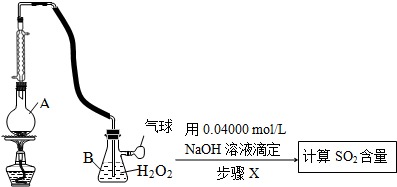
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氮元素只被氧化 | |
| B. | 豆科植物根瘤菌固氮属于自然固氮 | |
| C. | 其它元素也参与了氮循环 | |
| D. | 含氮无机物和含氮有机物可相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )| A. | H2SO4浓度为4mol/L | B. | 溶液中最终溶质为FeSO4 | ||
| C. | 原混合酸中NO3-浓度为0.2mol/L | D. | AB段反应为:Fe+2Fe3+→3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向两种气体中加入适量水,震荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体加压、冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com