
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 .
考点:
盐类水解的应用.
专题:
盐类的水解专题.
分析:
(1)AgNO3为强酸弱碱盐,Ag+离子水解使溶液呈酸性,从影响平衡移动的角度解答;
(2)FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3,加热分解生成Fe2O3;
(3)硫化钠水解呈碱性,从影响盐类水解平衡移动的因素分析.
解答:
解:(1)AgNO3为强酸弱碱盐,Ag+离子水解使溶液呈酸性,水解方程式为Ag++H2O  AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,
AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,
故答案为:酸;<;Ag++H2O  AgOH+H+;抑制;
AgOH+H+;抑制;
(2)FeCl3为强酸弱碱盐,水解生成Fe(OH)3和盐酸,盐酸易挥发,FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3,加热分解生成Fe2O3,故答案为:Fe2O3;
(3)硫化钠水解呈碱性,在溶液中存在S2﹣+H2O⇌HS﹣+OH﹣,加热少量NaOH,溶液中OH﹣浓度增大,可抑制水解,故答案为:NaOH.
点评:
本题考查盐类水解的应用,题目难度中等,注意盐类水解的原理以及影响因素,为该题的主要考查对象,学习中注意把握.


科目:高中化学 来源: 题型:
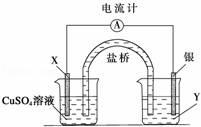
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填具体电极如Ag”).
查看答案和解析>>
科目:高中化学 来源: 题型:
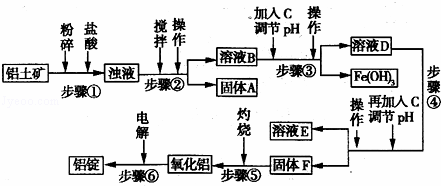
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为Si02、Fe2O3、Ca0、Mg0、Na20等.工业生产铝锭的工艺流程示意图如下:
一些氢氧化物沉淀的pH如表:
沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol/L) 4 2.3 10.4
完全沉淀pH(离子初始浓度为<10﹣5mol/L) 5.2 4.1 12.4
请回答下列问题:
(1)实验室进行步骤④的操作名称为 .
(2)固体A的化学式为 ,物质C的化学式为 .
(3)步骤④调节pH的范围为 .
(4)步骤⑥反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH﹣离子浓度分别为Amol•L﹣1与Bmol•L﹣1,则A和B的关系为( )
|
| A. | A>B | B. | A=10﹣4B | C. | B=10﹣4A | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:
在理论上不能用于设计原电池的化学反应是( )
|
| A. | 2FeCl3(aq)+2KI(aq)═2FeCl2(aq)+2KCl(aq)+I2(aq)△H<0 |
|
| B. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq)+8H2O(l)△H>0 |
|
| C. | 4Al(s)+6H2O(l)+3O2(g)═4Al(OH)3(s)△H<0 |
|
| D. | Zn(s)+2MnO2(s)+2H2O(l)═2MnOOH(s)+Zn(OH)2(s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
国际无机化学命名委员会在1989年曾经建议,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,第ⅠA族为第1列,稀有气体元素为第18列.按这个规定,下列说法不正确的是( )
|
| A. | 第15列元素的最高价氧化物为R2O5 |
|
| B. | 第2列元素中肯定没有非金属元素 |
|
| C. | 第17列元素的第一种元素无含氧酸 |
|
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
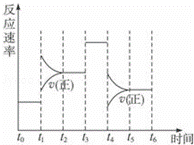
在一密闭体系中发生下列反应A(g)+3B(g)⇌2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是: 、 、 ;
(2)C体积分数最高的时间段是 .(填“tx﹣ty”)
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的VL HCl(气)溶于水配成1L溶液,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为()
A. 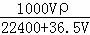 mol/L B.
mol/L B.  mol/L
mol/L
C.  mol/L D.
mol/L D. 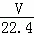 mol/L
mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com