
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为:xMg+Mo3S4 MgxMo3S4,下列说法正确的是( )
MgxMo3S4,下列说法正确的是( )
A. 电池放电时,Mg2+向负极迁移
B. 电池放电时,正极反应为Mo3S4+2xe﹣+xMg2+═MgxMo3S4
C. 电池充电时,阴极发生还原反应生成Mo3S4
D. 电池充电时,阳极反应为xMg﹣2xe﹣═xMg2+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
将8g铁片放入100mLCuSO4溶液中,Cu2+全部被置换后,取出附有铜的铁片洗涤、干燥、称重,其质量变为8.2g,则原溶液中CuSO4的物质的量浓度是
A. 0.125 mol•L-1 B. 0.25 mol•L-1 C. 0.175 mol•L-1 D. 0.5 mol•L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列除去杂质所用的方法正确的是
A. 除去Fe(OH)3胶体中的少量FeC13溶液:将混合物进行过滤
B. 除去Na2CO3溶液中少量NaHCO3:向溶液中通入过量的CO2
C. 除去NaHCO3固体中少量Na2CO3粉末:把固体置于坩埚中充分加热
D. 除去FeC12溶液中少量FeC13:加入足量铁屑,充分反应后过滤
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z2+与Y2-具有相同的电子层结构。下列说法正确的是
A. 原子半径大小顺序:r(Z)>r(W)>r(Y)>r(X)
B. 元素Z和元素Y、W均能形成离子化合物
C. 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物
D. 元素Y分别与元素Z、W形成的化合物中化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:填空题
(1)甲烷在一定条件下可生成以下微粒:
A. 碳正离子(CH3+ ) B.碳负离子(CH3—)C. 甲基 (﹣CH3) D.碳烯 (:CH2)
①四种微粒中,键角为120°的是_____(填序号).
②碳负离子(CH3—)的空间构型为______,与CH3—互为等电子体的一种分子是__(填化学式)
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为_________.
②写出基态Cu2+的价电子排布式_____________.
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为___________.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为__;1mol尿素分子中,σ 键的数目为______________.
⑤Cu与O元素形成的某种化合物的晶胞结构如图所示,若阿伏伽德罗常数为NA,晶胞的边长为a pm,则氧元素对应的离子在该晶胞中的坐标是_____,该晶体的密度为__g•cm﹣3.
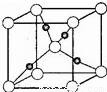
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法错误的是( )
A. 食盐中加有碘,用其配成的溶液遇淀粉变蓝
B. 厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大
C. 使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害
D. 硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
80℃时,NO2(g)+SO2(g) SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A. 平衡时,乙中SO2的转化率大于50%
B. 当反应平衡时,丙中c(SO2)是甲中的2倍
C. 温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:简答题
(1)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是___________;目前应用最多的太阳能电池的光电转化材料是______________;
(2)某气态氧化物的化学式为XO2,在标准状况下,1.92 g 该氧化物的体积为672 mL,则该氧化物的摩尔质量为______。
(3)某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:

①白色沉淀甲是________。
②试写出实验过程中生成气体B的离子方程式__________________________
③通过上述实验,可确定X溶液中一定存在的离子是_______________________
查看答案和解析>>
科目:高中化学 来源:2017届江西省协作体高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
某溶液中只可能含有Fe2+、Al3+、NH4+、CO32-、AlO2-、SO32-、SO42-、Cl-中的若干种(忽略水的电离),离子浓度均为0.2mol·L-1,现取该溶液加入稀硫酸后得强酸性X溶液,过程中无明显现象,取X溶液进行以下实验:
①X溶液中滴加Ba(NO3)2溶液至过量会产生白色沉淀A、无色气体A,A遇空气变成棕色;过滤,获得溶液A
②在溶液A中加入过量的NaOH溶液产生气体、沉淀B,过滤获得溶液B
③在溶液B中通入适量CO2气体有沉淀C产生. 则下列说法中正确的是( )
A. 原溶液中存在Fe2+、NH4+、AlO2-、SO42- B. 无法确定原溶液中是否含有Cl-、Al3+
C. 溶液A中存在的阳离子有Ba2+、Fe3+、NH4+、H+ D. 无法确定沉淀C的成分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com