
常温下,向10mL 0.1mol•L﹣1NaOH溶液中逐滴加入0.1mol•L﹣1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是()
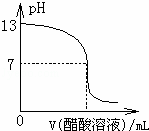
A. pH=7时,所加醋酸溶液的体积为10mL
B. pH<7时,溶液中:c(CH3COO﹣)>c(Na+)
C. 7<pH<13时,溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 继续滴加0.1 mol•L﹣1醋酸溶液,溶液pH可以变为1
考点: 中和滴定.
专题: 电离平衡与溶液的pH专题.
分析: A、醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使溶液呈中性,酸的物质的量应稍微大些
B、根据溶液呈电中性,溶液中阴阳离子所带电荷相等.
C、根据溶液中电荷守恒和溶液的酸碱性判断各种离子浓度相对大小.
D、根据醋酸是若电解质,不可能完全电离;
解答: 解:A、醋酸钠是强碱弱酸盐其水溶液呈碱性,要使溶液呈中性,所以醋酸溶液的体积为大于10mL,故A错误;
B、溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(CH3COO﹣)+(OH﹣),pH<7时,c(H+)>(OH﹣),所以
即c(CH3COO﹣)>c(Na+),故B正确;
C、7<pH<13时,溶液呈碱性,溶液中氢氧根离子浓度大于氢离子浓度,根据溶液中电荷守恒知,溶液中醋酸根离子浓度小于钠离子浓度,但醋酸根离子浓度和氢氧根离子浓度无法比较大小,故C错误;
D、醋酸是若电解质,不可能完全电离,所以溶液pH不可以变为1,故D错误;
故选:B.
点评: 本题考查了溶液酸碱性判断、溶液离子浓度的大小比较,本题难度中等,会根据电荷守恒解本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④压强⑤刻度线 ⑥酸式或碱式这六项中的()
A. ②④⑥ B. ③⑤⑥ C. ①②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
(1)加入B溶液110mL时,溶液中的沉淀是 ,溶液中的溶质是 .
(2)从90mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:Ba2++SO42﹣→BaSO4↓,Al(OH)3+OH﹣→AlO2﹣+2H2O溶液B中Na2SO4与NaOH的物质的量浓度之比为 ;
(3)计算A溶液中AlCl3的物质的量浓度,写出计算过程: .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 欲配制质量分数为10%的ZnSO4溶液,将10g ZnSO4•7H2O溶解在90g水中
B. 常温常压下,22.4L的NO2气体含有1.81×1024个原子
C. 为鉴别KCl、AlCl3和MgCl2溶液,各取少量分别向三种溶液中滴加NaOH溶液至过量
D. 某溶液中加入盐酸能产生使石灰水变浑浊的气体,则该溶液中一定含有CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为()
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
E、F、I标准状况下是气体单质,其中E为有剌激性气味的气体,X、Y是常见的金属单质,参加反应的水以及生成的水在图中已略去.

填写下列空白:
(1)E是 ;J是 .(写化学式)
(2)写出D+X→F+G的离子方程式: .
(3)写出A+B→C+E的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的是( )
|
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是()
A. 甲苯的硝化反应生成三硝基甲苯
B. 甲苯能使酸性高锰酸钾溶液褪色
C. 甲苯燃烧产生带浓烟的火焰
D. 1mol甲苯与3mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com