
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
科目:高中化学 来源: 题型:选择题
| A. | 氨基酸、多肽、蛋白质都具有两性 | |
| B. | 利用油脂在酸性条件下水解,可以产生甘油和肥皂 | |
| C. | 淀粉与纤维素分子式都为(C6H10O5)n,但结构不同,所以它们互为同分异构体 | |
| D. | 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.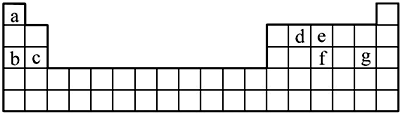
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C4H10 | C. | C5H8 | D. | C7H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | B位于第二周期第ⅣA族 | |
| B. | A在同周期元素中原子半径最小 | |
| C. | A、B没有最高正化合价 | |
| D. | B、C所形成的化合物会引发温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R原子的最外层上有4个电子 | |
| B. | RO3n-中的R只能被还原 | |
| C. | HnRO3一定是强酸 | |
| D. | R的单质既具有氧化性又具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操 作 | 实验现象 | 结 论 | |
| A | 某溶液中加入氯化钡、稀硝酸的 混合液 | 产生白色沉淀 | 该溶液中一定含有SO42-或SO32- |
| B | 取某溶液进行焰色反应 | 焰色呈黄色 | 该溶液一定是某钠盐的溶液 |
| C | 把湿润的碘化钾-淀粉试纸放入红棕色的气体中 | 试纸变蓝色 | 气体可能是NO2 |
| D | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液 | 溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
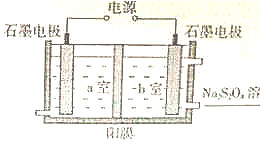
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
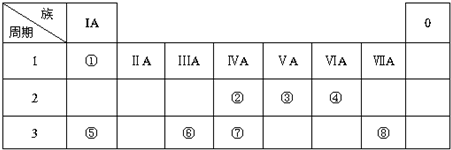
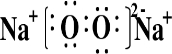 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com