
| A. | CH4、P4 | B. | SO2、CHCl3 | C. | PCl3、SO3 | D. | NH3、H2O |
分析 分子空间结构不对称,正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子;
中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,据此判断.
解答 解:A.CH4中C原子形成4个δ键,孤电子对个数为0,价层电子对数为4,为sp3杂化,分子构型正四面体形,空间结构对称为非极性分子;P4分子构型正四面体形,空间结构对称为非极性分子,故A错误;
B.SO2中S原子形成2个δ键,孤电子对个数=$\frac{1}{2}$(6-2×2)=1,价层电子对数为3,为sp2杂化,分子构型为V形,空间结构不对称为极性分子;CHCl3中C原子形成4个δ键,没有孤电子对,价层电子对数为4,为sp3杂化,空间结构不对称为极性分子,故B错误;
C.PCl3中P原子形成3个δ键,孤电子对个数=$\frac{1}{2}$×(5-3×1)=1,价层电子对数为4,为sp3杂化,分子构型为三角锥形,空间结构不对称为极性分子;SO3中S原子形成3个δ键,孤电子对个数=$\frac{1}{2}$×(6-2×3)=0,价层电子对数为3,为sp2杂化,分子构型为平面三角形,空间结构对称为非极性分子,故C错误;
D.NH3中N原子形成3个δ键,有1个孤电子对,为sp3杂化,分子构型为三角锥形,空间结构不对称为极性分子;H2O中O原子形成2个δ键,有2个孤电子对,为sp3杂化,分子构型为V形,空间结构不对称为极性分子,故D正确;
故选D.
点评 本题考查了原子杂化方式的判断、极性分子和非极性分子的判断,根据价层电子对互斥理论来分析解答即可,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水时,放出热量为b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2 充分反应后,放出热量小于d kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 过氧化钠与水的反应中,Na2O2作氧化剂,水作还原剂 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
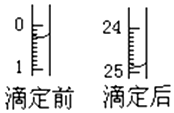 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3和 Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含有Cl- | |
| B. | 某溶液中先滴加稀硝酸酸化,再滴加几滴Ba(NO3)2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com