
| 选项 | 离子晶体 | 原子晶体 | 分子晶体 |
| A | NaOH | Ar | SO2 |
| B | K2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 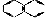 |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
分析 离子晶体是由阴、阳离子通过离子键形成的晶体,常见离子晶体有:常见的有强碱、活泼金属氧化物、大多数盐类等;
原子晶体是原子之间通过共价键形成的晶体,常见的原子晶体有:一些非金属单质,若金刚石、硼、硅、锗等;一些非金属化合物,如二氧化硅、碳化硅、氮化硼等;
分子晶体是分子间通过分子间作用力(包括范德华力和氢键)构成的晶体,常见的分子晶体有:所有非金属氢化物、部分非金属单质(金刚石、晶体硅等除外)、部分非金属氧化物(二氧化硅等除外)、几乎所有的酸、绝大多数的有机物晶体、所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、易挥发的固态物质等.
解答 解:A、NaOH属于离子晶体,Ar属于分子晶体,SO2属于分子晶体,故A错误;
B、K2SO4属于离子晶体,石墨属于混合晶体,S属于分子晶体,故B错误;
C、CH3COONa属于离子晶体,水晶(SiO2)属于原子晶体,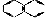 属于分子晶体,故C正确;
属于分子晶体,故C正确;
D、Ba(OH)2属于离子晶体,金刚石属于原子晶体,玻璃属于玻璃态物质,是非晶体,故D错误;
故选C.
点评 本题考查晶体类型判断,难度不大,掌握常见物质所属晶体类型,识记常见的原子晶体即可解答,注意石墨的晶体结构与玻璃态物质.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 经常使用一次性筷子、纸杯、塑料袋等 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Na+2H2O═Na++2OH-+H2↑ | ||
| C. | 2Fe+6H+═Fe3++3H2↑ | D. | NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
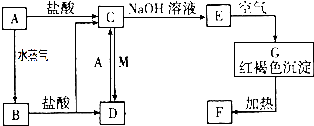
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com