
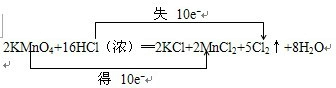

 ,故答案为:
,故答案为:
 ,可以知道当产生5mol氯气时,转移电子是10mol,所以如果反应转移了0.3mol 电子,则生成0.015mol的氯气,体积是22.4L/mol×0.015mol=3.36L,故答案为:3.36L.
,可以知道当产生5mol氯气时,转移电子是10mol,所以如果反应转移了0.3mol 电子,则生成0.015mol的氯气,体积是22.4L/mol×0.015mol=3.36L,故答案为:3.36L.

科目:高中化学 来源: 题型:
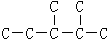 ,此烷烃的一溴代物有
,此烷烃的一溴代物有
查看答案和解析>>
科目:高中化学 来源: 题型:
药品:①2% NaOH溶液②稀HCl③稀H![]() SO
SO![]() ④饱和KHCO
④饱和KHCO![]() 溶液⑤浓H
溶液⑤浓H![]() SO
SO![]() ⑥CaCO
⑥CaCO![]() 固体⑦K
固体⑦K![]() CO
CO![]() 粉末
粉末
仪器装置(如图所示):
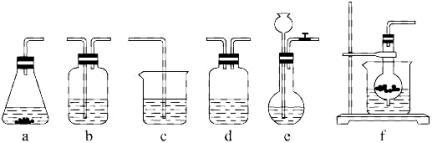
请根据题目要求完成下列问题:
请按下表要求,填写选择的装置和药品。
分项内容 | CO | 除杂洗气装置(Y) | 制备产品装置(Z) |
选择的装置 (填序号) |
|
| C |
选择的药品 (填序号) |
|
| ① |
(2)如何检验所选择的CO![]() 发生装置(X)的气密性,请写出主要操作过程:__________。
发生装置(X)的气密性,请写出主要操作过程:__________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为_____________,Y装置中除去的杂质为_________________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是______________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过________________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
化学式 | Na | NaHCO | NaOH | NaCl | Na |
溶解度 (g/100 g H | 21.3 | 9.60 | 107 | 35.8 | 19.4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)德国ICI公司用微生物合成技术制得新型聚酯塑料,聚-3-羟基丁酸(P-3-HB),成为一种新的生物降解性热塑性材料,用于农、渔、医用缝合线及骨折固定剂。请写出P-3-HB的结构简式_______________________。
(2)1996年美国罗姆斯公司研究的对环境安全的船舶防垢剂——“海洋9号”,获得美国“总统绿色化学挑战奖”。其结构简式为:
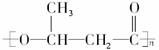
请填写下列空白:
①“海洋9号”的分子式为:_________________。
②该物质能否发生加成反应___________________(填“能”或“不能”)。若能,1 mol该物质最多可与_________________mol H2加成。
③结构中的两个氯原子能否发生取代反应_________________ (填“能”或“不能”),如能,请举例,用化学方程式表示___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
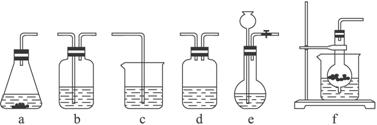
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品。
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:_________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________________,Y装置中除去的杂质为_____________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是____________________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_______________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100 g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO![]() 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液②稀HCl③稀H![]() SO
SO![]() ④饱和KHCO
④饱和KHCO![]() 溶液⑤浓H
溶液⑤浓H![]() SO
SO![]() ⑥CaCO
⑥CaCO![]() 固体⑦K
固体⑦K![]() CO
CO![]() 粉末
粉末
仪器装置(如图所示):
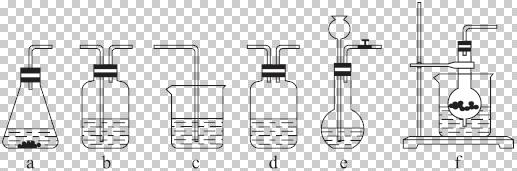
请根据题目要求完成下列问题:
请按下表要求,填写选择的装置和药品。
| 分项 内容 | CO (随开随用,随关随停) (X) | 除杂洗 气装置 (Y) | 制备产 品装置 (Z) |
| 选择的装置 (填序号) | C | ||
| 选择的药品 (填序号) | ① |
(2)如何检验所选择的CO![]() 发生装置(X)的气密性,请写出主要操作过程:__________。
发生装置(X)的气密性,请写出主要操作过程:__________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为_____________,Y装置中除去的杂质为_________________。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是______________。
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过________________%(质量分数)。
附:有关物质在常温(25 ℃)时的溶解度
| 化学式 | Na | NaHCO | NaOH | NaCl | Na |
| 溶解度 (g/100 g H | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com