
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中:NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
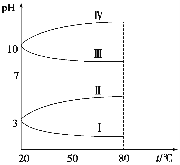
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
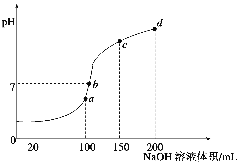
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
【答案】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.
(2)小于
(3)①Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小②10-3-10-11
(4)a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
试题分析:(1) Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.
(2)相同条件下,因为 NH4++H2O![]() NH3·H2O+H+,酸能抑制NH4+的水解,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)小于0.1 mol·L-1NH4HSO4中c(NH4+)。
NH3·H2O+H+,酸能抑制NH4+的水解,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)小于0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)①因NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,所以变化的曲线是Ⅰ;
②20℃时,0.1 mol·L-1NH4Al(SO4)2溶液pH=3,c(H+)=10-3mol·L-1,根据电荷守恒可知,2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+) -c(OH-)=(10-3-10-11)mol·L-1。
(4)酸和碱加入水中对水的电离有抑制作用,生成盐时,存在NH4+水解,对水的电离有促进作用,加入100mLNaOH时正好生成正盐,水解程度最大,是a点;而b点需要多加入一些NaOH,因此在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) 。


科目:高中化学 来源: 题型:
【题目】某同学在毕业体检时,检查出蛋白质摄入量不足,假如你是一名医生,你会建议他在平时的饮食中可适量增加的食物是( )
A.水果、蔬菜
B.米饭、面条
C.瘦肉、鸡蛋
D.奶油、牛油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,分类完全正确的一组是( )
A酸 | B碱 | C盐 | D氧化物 |
H2SO4 | Ba(OH)2 | H2S | H2O2 |
NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
HNO3 | NaOH | CaCO3 | CuO |
HCl | Na2CO3 | CuSO4 | MnO2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1) |
| 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为_____________; 硫化亚铁处加水的目的是_________________。 |
(2) |
| 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是______(必要时可以加热),该沉淀的化学式为_______________。 |
(4) |
| 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________; ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为_______%(保留2位小数,已折算标况)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁单质是从海水中提取的,已知海水提镁的主要步骤如图:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可选用_______。试剂②可选用_______。
(2)本生产流程主要牵涉三个化学反应:写出前两个式子
A.海水→沉淀:__________________(离子方程式)
B.沉淀→溶液:__________________(离子方程式)
C.MgCl2→Mg:
(3)海水中提镁中如何实现对镁离子的富集_______(填代号).
A.直接往海水中加入沉淀剂
B.高温加热蒸发海水后,再加入沉淀剂
C.利用晒盐后的苦卤水,再加入沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不能增大锌与稀硫酸反应制氢气的化学反应速率的是
A. 改用热的稀硫酸溶液 B. 向该稀硫酸溶液中加几滴硫酸铜溶液
C. 用浓硫酸代替稀硫酸 D. 使用粗锌粒或使用锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.20g Cu跟50.0mL l0.0mol/L的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有xmolH+,则此时溶液中合NO3-的物质的量为( )
A. xmol B. (x+0.1) mol C. 2xmol D. 0.1xmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1mol O的质量是16gmol﹣1
B.1mol CO2的质量是44 gmol﹣1
C.氢的摩尔质量是2 gmol﹣1
D.Na+的摩尔质量是23 gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2+、Fe3+与O![]() 、CN-、F-有机分子等形成的化合物具有广泛的应用。
、CN-、F-有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(2)Fe2+基态核外电子排布式为__________________________。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。
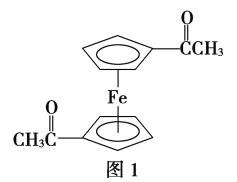
此物质中碳原子的杂化方式是______________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为___________________________。
(5)F-不仅可与Fe3+形成[FeF6]3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。
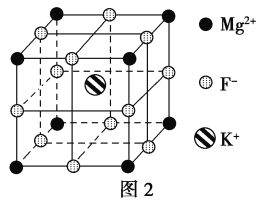
该晶体的化学式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com