
(14分)近几年来,我国中东部地区陷入严重的雾霾天气,面对全球近期的气候异常,环境问题再次成为焦点。非金属氧化物的合理控制和治理是优化我们生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
Ⅰ、目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-57kJ?mol-1
②4CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
③H2O(g)=H2O(l) △H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式________________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+ 2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |

Ⅰ、(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol
(2)①0.56 ②减小CO2的浓度 ③<
Ⅱ、(1)SO2+2H2O-2e-=4H++SO42- (2)①C ②HSO3-+H2O-2e-=SO42-+3H+
解析试题分析:Ⅰ、(1)根据反应①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol和反应②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol,③H2O(g)=H2O(l) △H=-44.0kJ/mol并依据盖斯定律可知,(①+②)÷2+③×2即得到反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l),所以该反应的反应热△H=(-574kJ/mol-1160kJ/mol)÷2-44kJ/mol×2=-955kJ/mol。
(2)①根据表中数据可知反应进行到20min时达到平衡状态,此时NO、氮气、和二氧化碳的浓度分别是0.040mol/L、0.030mol/L、0.030mol/L,所以该温度下平衡常数是 =0.56。
=0.56。
②30 min后NO和二氧化碳的浓度减少,而氮气的浓度增加,因此改变的条件可能是减小CO2的浓度促使平衡向正反应方向移动。
③若30min后升高温度重新达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3>4:3:3,这说明平衡向逆反应方向进行,因此正方应是放热反应,即该反应△H<0。
Ⅱ、(1)原电池中负极失去电子,发生氧化反应,所以SO2在负极通入,被氧化生成硫酸,负极电极反应式是SO2+2H2O-2e-=4H++SO42-。
(2)①A、当n(SO32-):n(HSO3-)=1:91时,溶液显酸性,这说明HSO3-的电离程度大于其水解程度,因此NaHSO3溶液中c(H+)>c (OH-),A不正确;B、Na2SO3溶液显碱性,则c (OH-)>c (HSO3-),B不正确;C、当吸收液呈中性时,亚硫酸钠的物质的量浓度小于亚硫酸氢钠的,因此溶液中c(Na+)>c (HSO3-)>c (SO32-)>c (OH-)=c(H+),C正确;D、当n(SO32-):n(HSO3-)=1:1时溶液显碱性,则根据物料守恒可知2c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),D不正确,答案选C。
②电解池中阳极与电源的正极相连,失去电子,发生氧化反应。所以阳极是HSO3-失去电子被氧化生成SO42-,则阳极电极反应式是HSO3-+H2O-2e-=SO42-+3H+。
考点:考查盖斯定律的应用、外界条件对反应速率和平衡状态的影响、平衡常数的计算、电极反应式的书写以及溶液中离子浓度大小比较等


科目:高中化学 来源: 题型:填空题
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知:
①P4(s、白磷)+5O2(g)=P4O10(s);Δ H=-2983.2 KJ·mol-1
②P(s、红磷)+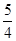 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1
试写出白磷转化为红磷的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是_ ② 反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有_③___生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源。工业上利用煤的气化产物(水煤气)合成甲醇和二甲醚。回答下列问题:
(1)制备二甲醚最后一步反应由Al2O3催化甲醇脱水合成,反应方程式为 。
(2)已知:CO(g)+2H2(g)=CH3OH (g) △H= —90.1kJ·mol-1 CO(g)的燃烧热是282.8 kJ·mol-1;H2的燃烧热是285.8 kJ·mol-1写出表示CH3OH (g) 燃烧热的热化学反应方程式 。
(3)二甲醚直接燃料电池比甲醇直接燃料电池更高效,等质量的二甲醚和甲醇完全放电转移电子的物质的量之比是 。用二甲醚直接燃料电池电解足量饱和食盐水,当消耗9.2g二甲醚时理论上阴极产生的气体的体积为 L。(标况下)
(4)在合成中伴有水煤气交换反应:CO(g)+H2O(g)  CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
| 温度 | 260℃ | 280℃ | 295℃ | 310℃ |
| CO转化率 | 89% | 80% | 75% | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分) 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。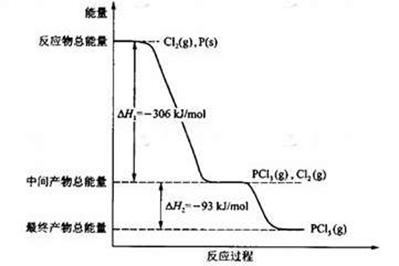
根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率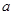 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为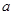 2,
2,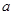 2
2 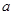 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是 。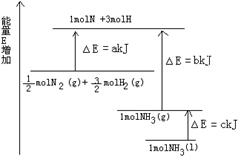
(2)已知:①H2O(g)=H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q2 kJ/mol ③C2H5OH(g)=C2H5OH(l) ΔH=-Q3 kJ/mol
则23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为 kJ(请用Q1、Q2、Q3来表示 )
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。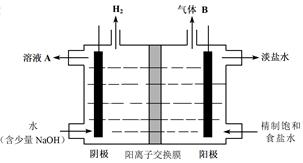
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_______________________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。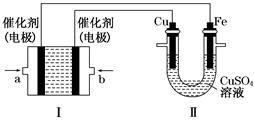
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是______________________________
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com