
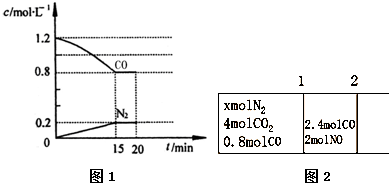
| △c |
| △t |
 SO3(g)+NO(g)
SO3(g)+NO(g)| 4 |
| 5 |
| x 2 |
| (1a-x)(2a-x) |
| 8 |
| 3 |
| 8 |
| 3 |
| ||
| 2L |
| 0.4mol/L |
| 15min |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
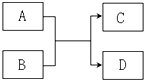 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
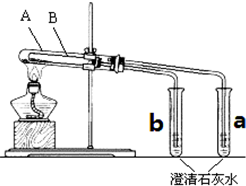 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和碳酸钠溶液中通入过量CO2 |
| B、氯化亚铁溶液中加入少量过氧化钠 |
| C、AlCl3溶液中加入过量氢氧化钠溶液 |
| D、氯化钙溶液中通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅是生产光纤制品的基本原料 |
| B、水玻璃可用于生产黏合剂和防火剂 |
| C、涂油层、通过电镀加上金属层、制成合金等都是保护金属的措施 |
| D、相同条件下,溶液中Cu2+、Zn2+、H+、Na+的氧化性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com