
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+═2Fe3++3H2↑ |
分析 A.电子、电荷不守恒;
B.漏写氧化剂水;
C.反应生成氯化钙、水、二氧化碳;
D.反应生成氯化亚铁、氢气.
解答 解:A.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故A错误;
B.金属铝溶于氢氧化钠溶液的离子反应为2H2O+2Al+2OH-═2AlO2-+3H2↑,故B错误;
C.碳酸钙溶于稀盐酸中的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故C正确;
D.铁屑溶于稀盐酸中的离子反应为Fe+2H+═Fe2++H2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
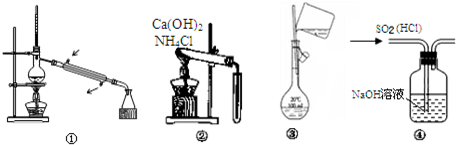
| A. | 图①常用于分离沸点不同且彼此互溶的液态混合物 | |
| B. | 图②可用于实验室制备并收集少量的NH3 | |
| C. | 图③表示的是实验室配制溶液转移过程 | |
| D. | 图④可用于除去SO2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
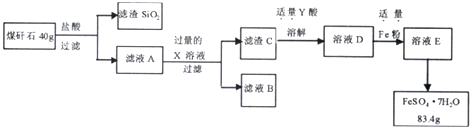
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
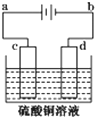 (1)电镀时,镀件与电源的负极连接.
(1)电镀时,镀件与电源的负极连接.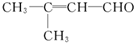 含氧官能团有醛基.
含氧官能团有醛基.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5?mol•L-1 | B. | 2.5?mol•L-1 | C. | ?d/400 mol•L-1 | D. | ?d/200mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
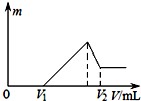
| A. | 向硫酸溶液中加入氢氧化钡溶液 | |
| B. | 向碳酸氢钠溶液中加入氯化钙 | |
| C. | 向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量 | |
| D. | 向氯化铝溶液中加入过量氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com