
【题目】氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品.
(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为 .
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN﹣H、N﹣N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2 , 则反应(填“放出”或“吸收”)kJ的能量.
(3)NH3﹣O2燃料电池的结构如图所示. 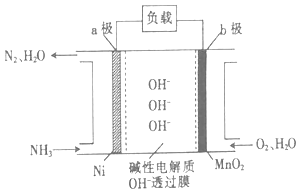
①a极为电池的(填“正”或“负”)极.
②当生成1molN2时,电路中流过电子的物质的量为 .
(4)联氨可以高效地脱除烟道气中的NO从而生成N2 , 该反应中氧化产物与还原产物的物质的量之比为 .
【答案】
(1)2NH4+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)放出;367
(3)负;6mol
(4)1:1
【解析】解:(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为:2NH4+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O,所以答案是:2NH4+Ca(OH)2
2NH3↑+CaCl2+2H2O,所以答案是:2NH4+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O;(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN﹣H、N﹣N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2 , 反应焓变△H=3×(193kJ/mol+390.8kJ×4KJ/mol)﹣946kJ/mol﹣4×3×390.8kJ/mol=﹣367KJ/mol,
2NH3↑+CaCl2+2H2O;(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN﹣H、N﹣N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2 , 反应焓变△H=3×(193kJ/mol+390.8kJ×4KJ/mol)﹣946kJ/mol﹣4×3×390.8kJ/mol=﹣367KJ/mol,
所以答案是:放出;367;(3)该燃料电池中负极反应为:2NH3﹣6e﹣+6OH﹣═N2+6H2O,正极反应为:O2+4e﹣+2H2O=4OH﹣ , 则电池总反应为:4NH3+3O2═2N2+6H2O,①a极通入燃料为负极,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3﹣6e﹣+6OH﹣═N2+6H2O,
所以答案是:负;②负极反应为:2NH3﹣6e﹣+6OH﹣═N2+6H2O,生成1mol氮气单质转移6mol,所以答案是:6mol;(4)联氨可以高效地脱除烟道气中的NO从而生成N2 , 反应的化学方程式为:N2H4+2NO=2N2+2H2O,反应中NO中氮元素化合价+2价变化为0价,得到还原产物,N2H4被氧化得到氮气为氧化产物,则反应中氧化产物与还原产物的物质的量之比为1:1,
所以答案是:1:1.
【考点精析】利用反应热和焓变对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是( )
A. N5+中含有36个电子B. O2与O3互为同位素
C. C60的摩尔质量为720D. H2与H3属于同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,关于金刚烷分子的说法中错误的是( ) 
A.分子中有4个 ![]() 结构
结构
B.分子中有4个由六个碳原子构成的碳环
C.金刚烷分子式是C10H16
D.金刚烷分子的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
A. (1-a)/7B. 3a/4C. 6(1-a)/7D. 12(1-a)/13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0
C.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
D.0.1 mol?L﹣1 Na2SO3溶液中:c(OH﹣)﹣c(H+)=2c(H2SO3)+c(HS ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为abXn-,下列有关该原子的说法正确的是( )
A. 含有的中子数为a+bB. 含有的电子数为a-n
C. 质量数为a+b+nD. 1mol该原子的质量约为bg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质.实验步骤如图: 
(1)实验中用已经准确量取的浓硫酸配制500mL 1molL﹣1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是 , .
(2)步骤②加入过量氯水的作用是 , 反应的离子方程式为 .
(3)步骤④中一系列操作步骤为、洗涤、灼烧、冷却、称量.
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 .
(5)下列操作会导致所测定的铁元素含量偏高的是 A.步骤③所加氨水量不足
B.步骤④洗涤不充分
C.步骤④灼烧不充分.
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1molL﹣1的硫酸溶液,过滤.取滤液加溶液,若溶液变成色,说明该补血剂已变质.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com