
【题目】(1)101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ热量,氢气的燃烧热△H =_______;氢气燃烧的热化学方程式为_______。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
①倒入NaOH溶液的正确操作是________(填选项字母,下同)。
A.沿玻璃棒缓慢倒入
B.一次性迅速倒入
C.分三次少量倒入
②使硫酸与NaOH溶液混合均匀的正确操作是_______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)工业合成氨反应为N2(g)+3H2(g)2NH3(g),一定条件下,在2 L密闭容器中进行实验,测得有关数据如下表所示:
物质 | N2(g) | H2(g) | NH3(g) |
起始(mol) | 2 | 7 | 0 |
10 s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则010 s内,用氢气的浓度变化表示的平均反应速率是_______,该反应的化学平衡常数是_________。根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是_______ ,从而达到反应气体循环利用的目的。
【答案】285.8kJ/mol 2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ/mol B D 0.12mol/(L·s) 0.25 降温使氨成为液体,与氨气和氢气分离开
【解析】
(1) 101kPa下,1g即0.5molH2完全燃烧生成液态水放出142.9kJ热量,则1mol H2完全燃烧生成液态水放出142.9kJ×2=285.8 kJ热量,即氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ/mol;
(2)
①中和热的测定中,必须尽量减少热量散失,所以倒入氢氧化钠溶液时,必须一次并且迅速倒入烧杯中,所以B正确;
②A.温度计用于测定温度,不能使用温度计搅拌溶液,A错误;
B.揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,B错误;
C.轻轻地振荡烧杯,会导致溶液溅出,甚至导致热量散失,影响测定结果,C错误;
D.用套在温度计上的环形玻璃棒轻轻地搅动,可以使硫酸和氢氧化钠溶液混合均匀,又可以减少热量散失,D正确;故选D。
(3)10s内,生成NH3的物质的量为1.6mol,此时消耗H2的物质的量为![]() mol=2.4mol,根据化学反应速率表达式,v(H2)=
mol=2.4mol,根据化学反应速率表达式,v(H2)=![]() = 0.12mol/(L·s);达到平衡时,n(NH3)=2mol,n(H2)=4mol,n(N2)=1mol,根据平衡常数表达式K=
= 0.12mol/(L·s);达到平衡时,n(NH3)=2mol,n(H2)=4mol,n(N2)=1mol,根据平衡常数表达式K=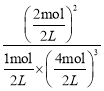 =0.25;NH3易液化,可以采用降温使NH3成为液体,与N2和H2分离开。
=0.25;NH3易液化,可以采用降温使NH3成为液体,与N2和H2分离开。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
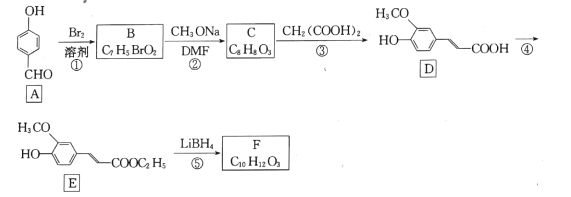
【题目】药物中间体F的一种合成路线如图:
已知:RCOOR′![]() RCH2OH+R′OH(R为H或烃基,R'为烃基)
RCH2OH+R′OH(R为H或烃基,R'为烃基)
回答下列问题;
(1)A中官能团名称是 __________。
(2)反应①的反应类型是 ____。
(3)反应②的化学方程式为 ___________。
(4)反应④所需的试剂和条件是______________。
(5)F的结构简式为____。
(6)芳香化合物W是E的同分异构体,W能水解生成X、Y两种化合物,X、Y的核磁共振氢谱均有3组峰,X的峰面积比为3:2:1,Y的峰面积为1:1:1,写出符合题意的W的结构简式 ___(写一种)。
(7)肉桂酸![]() 广泛用于香料工业与医药工业,设计以苯甲酸甲酯和丙二酸为起始原料制备肉桂酸的合成路线:_______________(无机试剂任用)。
广泛用于香料工业与医药工业,设计以苯甲酸甲酯和丙二酸为起始原料制备肉桂酸的合成路线:_______________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组的同学在实验室利用现代先进仪器,获得了某有机物R的相关图谱如下:

回答下列问题:
(1)上图中,甲为_____图,获得该图谱所使用的仪器名称为_______;乙为_____图,获得该图谱所使用的仪器名称为__________________。
(2)已知R属于醇类物质
①结合图谱信息可推知R为 ___________(写名称),写出其与金属钠反应的化学方程式:________________。
②该有机物R_______(填“有”或“无”)同分异构体(不考虑立体结构),若有,请写出其同分异构体的结构简式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2(g)△H1
②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3
④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向温度为300℃的2 L密闭容器中充入2 mol SO2和1 mol O2,发生反应2SO2 (g)+ O2 (g) ![]() 2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
A.该温度下,反应的平衡常数K =1620
B.SO2和O2的平衡转化率相等
C.平衡后保持温度和容器体积不变,再充入SO3(g),平衡常数不变
D.若不再向容器中加入任何物质,仅改变条件不可能使SO2的浓度达到1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是( )
A.Na2S的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.NaHCO3的电离:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C.HSO3-的电离:HSO3-![]() H++SO32-
H++SO32-
D.硫氢化钠溶液呈碱性:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
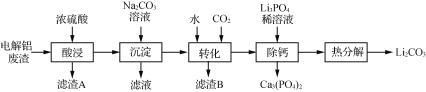
已知:①Li2CO3的溶解度:0 ℃ 1.54 g;20 ℃ 1.33 g;80 ℃ 0.85 g。
②20 ℃,Ksp[Ca3(PO4)2]=2×10-33,Ksp(CaHPO4)=1×10-7。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的气体,写出AlF3发生反应的化学方程式:______。

(2)滤渣B的主要成分是________。
(3)“转化”后所得LiHCO3溶液中含有的Ca2+需要加入Li3PO4除去。除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如右图所示。
①随着温度升高最终Li2CO3的产率逐渐减小的原因是___________。
②当温度高于50 ℃时,除钙率下降的原因可能是__________________。
(4)热分解后,获得Li2CO3需趁热过滤的原因是_______________________。
(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),该反应的离子方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com