
| A.AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
| B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 |
| C.用加热的方法可除去KNO3溶液中混有的Fe3+ |
| D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/L的Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| B.醋酸钠溶液与盐酸混合之后的中性溶液:c(Na+)> c(Cl-) >c(CH3COOH) |
| C.等浓度、等体积的氨水与盐酸的混合溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.pH=4的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC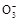 )+c(H+)>c(C )+c(H+)>c(C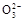 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S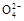 )>c(N )>c(N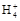 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC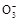 )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

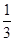 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Cu2+ | 5. 2 | 6. 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
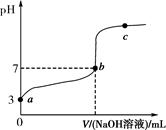
| A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+) |
D.a、b、c点表示的溶液中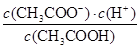 均相等 均相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com