
| A、在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO3- |
| B、用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O |
| C、NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
| D、10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |


科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外的三个能级上电子数相等 |
| Y | Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等 |
| Z | Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体 |
| W | 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A、氢化物稳定性的强弱:b>d |
| B、金属性的强弱:f<g |
| C、元素e的氧化物只能与酸反应 |
| D、元素a与元素d形成的化合物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内反应掉nmolI2同时生成2nmolHI |
| B、有1molH-H键断裂,同时有1molI-I键形成 |
| C、容器内压强不再随时间而变化 |
| D、H2、I2、HI的浓度之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
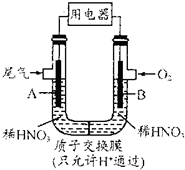 某化学小组构想将汽车尾气(NO、NO2)转化为重要化工原料HNO3,其原理如示意图,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要化工原料HNO3,其原理如示意图,其中A、B为多孔材料.下列说法正确的是( )| A、电解质溶液中电流方向由B到A,电子流向与之相反 |
| B、电极A表面反应之一:NO-3e-+2H2O=NO3-+4H+ |
| C、电极B附近c(NO3-)增大 |
| D、该电池工作时,每转移4mole一消耗22.4 L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同素异形体间在一定条件下可以相互转换,转换过程中发生的是物理变化 |
| B、各同位素原子核中质子数一定相同,中子数一定不同,质量数可能相同 |
| C、CuSO4与CuSO4?5H2O混合后得到的是混合物;水和冰混合后得到的是纯净物 |
| D、氨水可以导电,但氨水是非电解质;氯化银溶液导电性差,但氯化银是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 充电 |
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com