
| A.通入CH4的X极是负极,通入O2的Y极是正极 |
| B.放电一段时间后,电解质溶液中KOH的物质的量不变 |
| C.在标准状况下,通入5.6 LO2,完全反应时有1.0 mol电子转移 |
| D.放电时,通入甲烷一极附近的pH升高 |
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:不详 题型:填空题
| | 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
| (1) | H2 | | | | |
| (2) | CO | | | | |
| (3) | CH4 | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.微热 |
| B.加入适量氧化铜 |
| C.加入少量硫酸铜溶液 |
| D.加水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
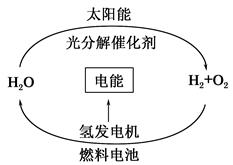
| A.燃料电池能够使化学反应产生的能量转化为电能 |
| B.燃料电池中通入H2的一极作负极,发生氧化反应 |
| C.在此循环中发生了反应:2H2O??2H2↑+O2↑ |
| D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
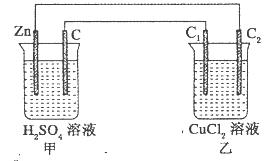
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
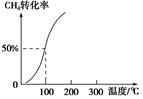
 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。| A.c(H2)减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c(H2)/c(CH3OH)减小 |
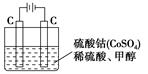
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com