
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
(1)海水中无机碳的存在形式及分布如下图所示:

用离子方程式表示海水呈弱碱性的原因______________.已知春季海水pH=8.1,预测夏季海水碱性将会_____________(填写“增强”或“减弱”),理由是_________________________.
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________.
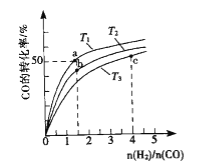
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
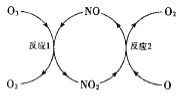
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________。
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________;c点所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).

【答案】HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH- 增强 一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH- 增强 一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱 C 催化剂 NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-) >
H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱 C 催化剂 NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-) >
【解析】
(1)本小题考查是盐类水解,强碱弱酸盐水解显碱性,强酸弱碱盐显酸性;水解平衡为吸热反应,夏天温度升高,水解平衡正向移动,溶液碱性增强;
(2)A.图中![]() 值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点
值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点![]() 相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b;
相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b;
B.图中![]() 一定时,CO的转化率:T1>T2>T3,正反应为放热反应,
一定时,CO的转化率:T1>T2>T3,正反应为放热反应,![]() 一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3;
一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3;
C.利用三段式求出T1温度下平衡常数K,在通入0.5 mol co和0.5 mol CH3OH 后求出Qc,比较K和Qc;
(3)①反应过程如图1是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气;
②Ⅰ.O3(g)+O(g)═2O2(g)△H=-143kJ/mol
Ⅱ.O3(g)+NO(g)═NO2(g)+O2(g)△H1=-200.2kJ/mol
盖斯定律计算Ⅰ-Ⅱ得到反应2的热化学方程式;
(4)b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性;c点pH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。
,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。
(1)海水中无机碳的存在形式主要是HCO3-、CO32-,两离子为弱酸根离子,水解使海水显碱性,离子方程式为HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH-;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH-;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。本小题答案为:HCO3-+H2O
H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。本小题答案为:HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH-;增强;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH-;增强;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。
H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。
(2)A.图中![]() 值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点
值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点![]() 相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b,可知H2转化率:a>b>c,故A错误;
相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b,可知H2转化率:a>b>c,故A错误;
B.图中![]() 一定时,CO的转化率:T1>T2>T3,正反应为放热反应,
一定时,CO的转化率:T1>T2>T3,正反应为放热反应,![]() 一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3,故B错误;
一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3,故B错误;
C.T1温度下,a点![]() =1.5,起始时CO为1mol,则氢气为1.5mol,平衡时CO转化率为50%,反应的CO为0.5mol,容器体积为1L,则:
=1.5,起始时CO为1mol,则氢气为1.5mol,平衡时CO转化率为50%,反应的CO为0.5mol,容器体积为1L,则:
CO(g) + 2H2(g) CH3OH(g)
起始浓度(mol/L): 1 1.5 0
变化浓度(mol/L): 0.5 1 0.5
平衡浓度(mol/L): 0.5 0.5 0.5
故T1温度下平衡常数K=![]() ,而Qc=
,而Qc=![]() ,所以平衡不移动,故C正确;
,所以平衡不移动,故C正确;
D.c点状态下再通入1 molCO和4 molH2,等效为在原平衡的基础上压强增大一倍,正反应为气体体积减小的反应,故平衡正向移动,新平衡中H2的体积分数减小,故D错误。答案选C。
(3)①反应过程是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气,反应过程中NO参与反应最后又生成,作用是催化剂。本小题答案为:催化剂。
②Ⅰ.O3(g)+O(g)═2O2(g)△H=143kJ/mol
Ⅱ.O3(g)+NO(g)═NO2(g)+O2(g)△H1=200.2kJ/mol
盖斯定律计算ⅠⅡ得到反应2的热化学方程式:NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol。本小题答案为:NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol。
(4)b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,则溶液中各离子浓度由大到小的顺序是c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-);c点pH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。本小题答案为:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-);>。
,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。本小题答案为:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-);>。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者____后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是__(填字母编号)。
A.Na2CO3 |
B.NaHCO3 |
C.NaAlO2 |
D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
温度(℃) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
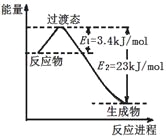
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为__________。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:

①催化剂b表面的电极反应式为__________。
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O2_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
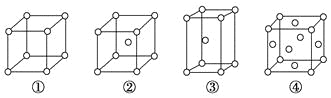
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业合成尿素时常用![]() 与
与![]() 作原料进行生产.
作原料进行生产.
![]() 如图为合成氨反应,氮气、氢气按体积比为1:3投料时不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数图象.
如图为合成氨反应,氮气、氢气按体积比为1:3投料时不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数图象.
![]() 若分别用
若分别用![]() 和
和![]() 表示从反应开始至达平衡状态A、B时的化学反应速率,则
表示从反应开始至达平衡状态A、B时的化学反应速率,则![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 在
在![]() 、
、![]() 下,
下,![]() 的转化率为
的转化率为
______ ![]() 计算结果保留小数点后1位
计算结果保留小数点后1位![]() .
.
![]() 将
将![]() 氨水与
氨水与![]() 的盐酸等体积混合,若反应后混合溶液显碱性,则反应混合液中各离子浓度由大到小的顺序为 ______ .
的盐酸等体积混合,若反应后混合溶液显碱性,则反应混合液中各离子浓度由大到小的顺序为 ______ .
![]() 与
与![]() 经过两步反应生成尿素,两步反应的能量变化示意图如下:
经过两步反应生成尿素,两步反应的能量变化示意图如下: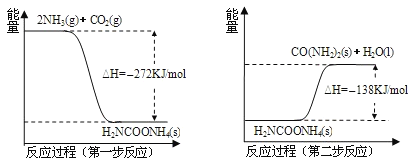
![]() 与
与![]() 反应生成尿素的热化学方程式为 ______ .
反应生成尿素的热化学方程式为 ______ .
![]() 工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 ______
工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 ______ ![]() 填序号
填序号![]()
A.升高温度 ![]() 加入催化剂
加入催化剂 ![]() 将尿素及时分离出去
将尿素及时分离出去 ![]() 增大反应体系的压强
增大反应体系的压强
![]() 某实验小组模拟工业上合成尿素的条件,在一体积为
某实验小组模拟工业上合成尿素的条件,在一体积为![]() 的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
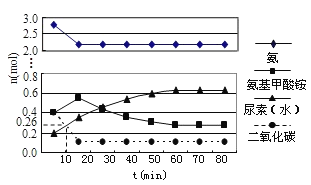
![]() 已知总反应的速率通常由慢的一步反应决定,则合成尿素总反应的速率由第 ______ 步反应决定.
已知总反应的速率通常由慢的一步反应决定,则合成尿素总反应的速率由第 ______ 步反应决定.
![]() 反应进行到10min时测得
反应进行到10min时测得![]() 的物质的量如图所示,则用
的物质的量如图所示,则用![]() 表示的第一步反应的速率
表示的第一步反应的速率![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:
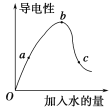
(1)醋酸的电离平衡常数表达式为:__________________________。
(2)a、b、c三点c(H+)由大到小的顺序是________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与![]() 稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
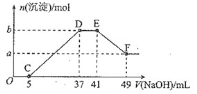
A.![]()
B.OC段反应的离子方程式为![]()
C.D点对应溶液中的溶质为![]() 和
和![]()
D.原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性丙烷燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是( )
,下列说法正确的是( )
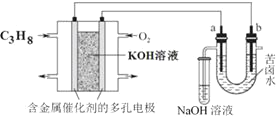
A.电池工作时,负极反应式为:![]()
B.电解时,a电极周围首先放电的是![]() 而不是
而不是![]() ,说明当其他条件相同时后者的还原性强于前者
,说明当其他条件相同时后者的还原性强于前者
C.电解时,电子流动的路径是:负极![]() 外电路
外电路![]() 阴极
阴极![]() 溶液
溶液![]() 阳极
阳极![]() 正极
正极
D.忽略能量损耗,当电池中消耗16gO2时,a极周围会产生0.71gCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com