
分析 同温同压下,Vm相同,同体积时由n=$\frac{V}{Vm}$可知,物质的量相同,设均为1mol,结合物质的构成及M计算.
解答 解:同温同压下,Vm相同,同体积时由n=$\frac{V}{Vm}$可知,物质的量相同,设均为1mol,
则N2和SO2分子数之比为1:1,物质的量之比为1:1,原子总数之比为1×2:1×3=2:3,摩尔质量之比为28g/mol:64g/mol=7:16,
故答案为:1:1;1:1;2:3;7:16.
点评 本题考查物质的量的计算,为高频考点,把握体积与物质的量的关系、物质的构成为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:5 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离度 | B. | c(H+) | C. | 电离平衡常数K碱 | D. | c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国目前最主要的能源是煤炭 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 人类目前所直接利用的能量大部分是由化学反应所产生的 | |
| D. | 煤、石油、天然气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
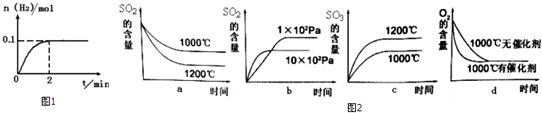
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com