
| A. | 石油分馏是利用加热的方法将石油分成不同沸点产物的方法 | |
| B. | 石油分馏得到的分馏产物仍是一些混合物 | |
| C. | 石油分馏可以得到石油气、汽油、煤气、乙烯和丙烯等产品 | |
| D. | 石油分馏过程是加热条件下发生的化学变化 |
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸在浓硫酸作用下共热至50~60℃属于加成反应 | |
| B. | 乙烯通入溴水中,使溴水褪色属于取代反应 | |
| C. | 苯在一定条件和氢气反应,属于加成反应 | |
| D. | 乙烯和水在一定条件下反应生成乙醇属于氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7mol•L-1的溶液 | |
| B. | pH=pOH 的溶液 | |
| C. | pH=14-pOH 的溶液 | |
| D. | 浓度均为0.1 mol•L-1的一元酸与氢氧化钠溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 相关信息 | 元素周期表中核电荷数最小的元素 | 大气中含量最多的元素,其某些氧化物为大气中常见的污染物 | 地壳中含量最多的金属元素 | 原子最外层电子数是电子层数的二倍 |
| A. | X、Y、W三种元素不可能形成离子化合物 | |
| B. | Z的简单离子半径比Y的简单离子半径大 | |
| C. | 工业上常常通过电解Z的熔融氯化物的方法来获得Z的单质 | |
| D. | W的单质在氧气中燃烧火焰呈蓝紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
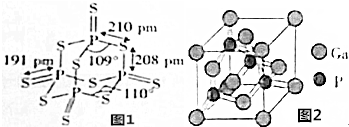
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com