
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.向NH4HCO3溶液中加过量Ca(OH)2溶液:HCO3-+OH-+Ca2+=CaCO3↓+H2O |
B.用惰性电极MgCl2电解水溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
C.向偏铝酸钠溶液中加入少量硫酸氢钠溶液:2AlO2 +H +H +H2O=Al(OH)3↓ +H2O=Al(OH)3↓ |
D.浓盐酸跟二氧化锰混合共热:MnO2+4H +4Cl +4Cl =Mn =Mn +2H2O+2Cl2↑ +2H2O+2Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题






| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe(OH)2溶液中加入HNO3溶液:Fe(OH)2+2H+=2H2O+Fe2+ |
| B.盐酸除去铜器表面的铜绿:Cu2(OH)2CO3+4H+=3H2O+2Cu2++CO2↑ |
| C.氯气可以降低的SO2的漂白性:SO2+Cl2+2H2O=2Cl—+4H++SO42— |
| D.CO2通入饱和碳酸钠溶液:CO2+ CO32—+2Na++H2O=2NaHCO3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (铁氧磁体,罗马数字表示元素价态)的沉淀。
(铁氧磁体,罗马数字表示元素价态)的沉淀。| A.x ="0.5" ,a ="8" | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的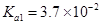 ,
, ;
; )的
)的 ,
,
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
B. |
C. |
D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X可能是周期表中第二周期元素 |
| B.X元素的原子最外层上有7个电子 |
| C.X2是还原产物,H2O是氧化产物 |
| D.若生成3 mol X2,转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B.NO2与水的反应:3NO2+H2O=NO3-+NO+2H+ |
| C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com