
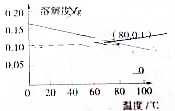
| A. | 熟石灰的溶解是吸热过程 | |
| B. | 温度升高时熟石灰的熔解速率减慢 | |
| C. | 80℃时,熟石灰的Ksp约等于9.8×10-6 | |
| D. | 若硝酸钾中含有少量的熟石灰,可用溶解、过滤的方法进行提纯 |
分析 A.依据熟石灰的溶解度随温度变化的曲线解答;
B.升温能够加速物质的溶解;
C.计算80℃时,熟石灰饱和溶液中钙离子、氢氧根离子浓度,依据溶度积表达式计算解答;
D.硝酸钾溶解度随着温度升高而升高,氢氧化钙溶解度随着温度升高而降低,所以二者可以通过降温结晶法分离;
解答 解:A.依据熟石灰溶解度随温度变化的曲线可知,随着温度升高氢氧化钙溶解度减小,说明熟石灰的溶解是放热过程,升高温度抑制氢氧化钙的溶解,故A错误;
B.升温能够加速物质的溶解,故B 错误;
C.80℃时,氢氧化钙溶解度为0.1g,物质的量为:$\frac{0.1g}{74g/mol}$=0.00135mol,100g溶液体积约为100mL,则氢氧化钙物质的量浓度为:$\frac{0.00135mol}{0.1L}$=0.0135mol/L,依据Ca(OH)2=Ca2++2OH-,钙离子浓度为0.0135mol/L,氢氧根离子浓度为0.027mol/L,则熟石灰的Ksp=0.0135mol/L×0.027mol/L×0.027mol/L=9.8×10-6(mol/L)3,故C正确;
D.硝酸钾溶解度随着温度升高而升高,氢氧化钙溶解度随着温度升高而降低,所以二者可以通过降温结晶法分离,故D错误;
故选:C.
点评 本题考查了物质的溶解度,准确把握熟石灰的溶解度随温度变化的曲线是解题关键,注意溶度积常数的计算,题目难度中等.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:解答题
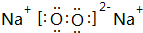 ,其中含有的化学键为离子键和共价键.
,其中含有的化学键为离子键和共价键.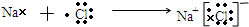 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | B. | 负极反应为Zn+2OH--2e-=Zn(OH)2 | ||
| C. | 工作时负极区溶液的pH增大 | D. | 工作时溶液中K+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
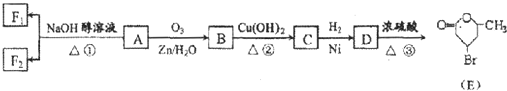
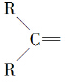 ”生成酮,“
”生成酮,“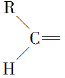 ”生成“
”生成“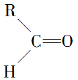 ”,
”,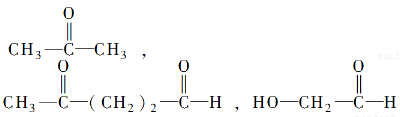
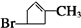
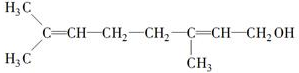 或
或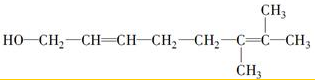 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质沸点:W>Z | |
| B. | 离子半径:Y2->Z- | |
| C. | 原子序数:Z>Y>X>W | |
| D. | W分别与Y、Z形成的化合物中均只含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
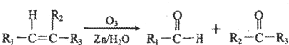
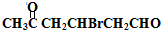 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$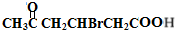 +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
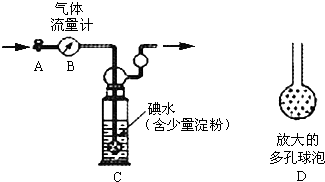 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质内部储存的能量--化学反应的热效应 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 原子核外电子排布--元素在周期表中的位置 | |
| D. | 有效碰撞几率的高低--化学反应速率的大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com