
| A. | 向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失 | |
| B. | 向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状沉淀 | |
| C. | 钠与氧气在加热条件下反应,生成白色固体 | |
| D. | 将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来 |
分析 A、氢氧化铝不溶于氨水;
B、强酸制弱酸;
C、钠与氧气在加热条件下反应,生成淡黄色的固体;
D、铝在酒精灯上加热到熔化,生成熔点高的氧化铝,熔融但不滴落.
解答 解:A、向AlCl3溶液中逐滴加入氨水,产生白色沉淀氢氧化铝,不溶于氨水,故A错误;
B、向Na2SiO3溶液中逐滴加入稀盐酸反应生成硅酸,硅酸是白色胶状物,故B正确;
C、钠与氧气在加热条件下反应,生成淡黄色的固体,故C错误;
D、铝在酒精灯上加热到熔化,因为表面有高熔点的氧化铝包着,所以不滴落,故D错误;
故选B.
点评 本题考查了物质性质的分析判断,反应产物、反应现象的分析注意物质反应过程中的特征现象应用,掌握基础是关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
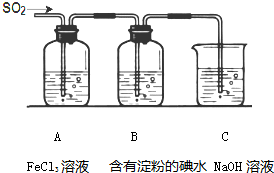 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐溶液是电解质 | |
| B. | 溶液和胶体的本质区别是有无丁达尔效应 | |
| C. | 可用NaOH溶液回收铝合金中的镁 | |
| D. | 小苏打溶液呈碱性的原因:HCO3-?OH-+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下22.4L H2中含有氢分子的个数为2NA | |
| B. | 56g Fe与稀盐酸充分反应时失去的电子数为2NA | |
| C. | 44g CO2中含有氧原子的个数为2NA | |
| D. | 1L 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com