
| A、N2与H2在一定条件下反应生成NH3 |
| B、NO遇O2转化为NO2 |
| C、硝酸工厂用NH3氧化法制NO |
| D、由NH3合成尿素 |
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4?7H2O进行消毒、净化,以改善水质 |
| B、铝表面有一层致密的氧化薄膜,故铝制容器可用来腌制咸菜等 |
C、 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: |
| D、借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
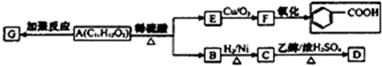
查看答案和解析>>
科目:高中化学 来源: 题型:
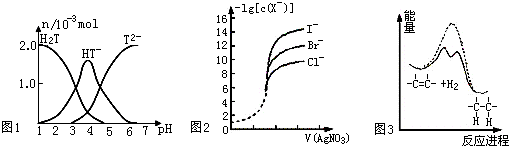
| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com