
将0.1 mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液至过量。请回答: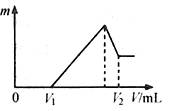
(1)写出与铝有关的离子方程式:
(2)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,
V2= mL。沉淀的最大质量是 g。
(3)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
科目:高中化学 来源: 题型:
将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH
![]() 溶液。请回答:
溶液。请回答:
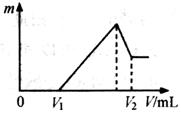
![]() ⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当
![]() V1=160mL时,则金属粉末中n(Mg)= mol,V2=
V1=160mL时,则金属粉末中n(Mg)= mol,V2=
![]() mL。
mL。
![]() ⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶 液的体积V(NaOH) mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶 液的体积V(NaOH) mL。
![]() ⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁、铝混合物溶于100mL 2mol·L![]() 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L![]() 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)
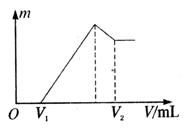
(1)若在滴加NaOH溶液的过程中沉淀质量![]() 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当![]() mL时,则金属粉末中
mL时,则金属粉末中![]() (Mg)= mol,
(Mg)= mol,![]() mL。
mL。
(2)①要配制100 mL 2mol·L![]() 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
②下列操作会使所配的溶液浓度偏小的是( )(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液至过量。请回答:
(1)写出与铝有关的离子方程式:
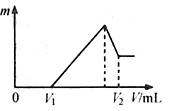
(2)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,
V2= mL。沉淀的最大质量是 g。
(3)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三上学期10月份月考(理综)化学卷 题型:填空题
将0.1 mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液至过量。请回答:

(1)写出与铝有关的离子方程式:
(2)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,
V2= mL。沉淀的最大质量是 g。
(3)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三上学期期中考试化学试卷 题型:填空题
将0.1 mol的镁、铝混合物溶于100mL 2mol·L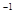 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L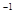 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)

(1)若在滴加NaOH溶液的过程中沉淀质量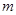 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当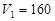 mL时,则金属粉末中
mL时,则金属粉末中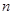 (Mg)= mol,
(Mg)= mol,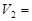 mL。
mL。
(2)①要配制100 mL 2mol·L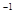 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
②下列操作会使所配的溶液浓度偏小的是( )(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com