
| A. | ①③⑤⑦ | B. | ②④⑤⑦ | C. | ②③⑥⑦ | D. | ③④⑥⑦ |
分析 ①通入大量NH3后的溶液中OH-能分别与NH4+、Al3+反应;
②pH=1的溶液中存在大量氢离子,该组离子之间不反应,都不与氢离子反应;
③水电离出的c(H+)=1×10-12 mol/L溶液中,可能为酸或碱溶液,酸溶液中H+分别与CO32-、S2-能反应;
④加入足量NaOH溶液,碳酸氢根和铵根离子都参与反应;
⑤醋酸为弱酸,离子方程式中醋酸不能拆开;
⑥硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,硫酸氢钠与氢氧化钡按照物质的量2:1反应;
⑦铁离子与铜反应生成亚铁离子和铜离子.
解答 解:①通入大量NH3后的溶液中显碱性,OH-能分别与NH4+、Al3+结合,则不能共存,故①错误;
②pH=1的溶液中该组离子之间不反应,则能大量共存的离子,故②正确;
③水电离出的c(H+)=1×10-12 mol/L溶液中,水的电离受到抑制,可能为酸或碱溶液,酸溶液中H+分别与CO32-、S2-能反应,则不能大量共存,故③错误;
④NH4HCO3溶液加入足量NaOH溶液共热生成碳酸钠、氨气和水,则离子反应为HCO3-+NH4++2OH-═NH3↑+H2O+CO32-,故④错误;
⑤碳酸钙和醋酸都不能拆开,用食醋溶解水垢的离子反应为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故⑤错误;
⑥硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,反应生成硫酸钡、硫酸钠和水,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故⑥正确;
⑦用FeCl3溶液腐蚀铜电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,遵循电荷守恒和质量守恒定律,故⑦正确;
故选C.
点评 本题考查离子的共存、离子方程式的书写判断,题目浓度中等,明确离子反应发生条件及离子方程式的书写原则为解答关键,试题知识点较多,充分考查学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 分子中含有碳元素和氢元素的化合物是烃类 | |
| B. | 相对分子质量相同的物质一定是同种物质 | |
| C. | 相对分子质量相差14的两种有机物,一定是属于同系物 | |
| D. | 分子式相同结构不同的有机物一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:
CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
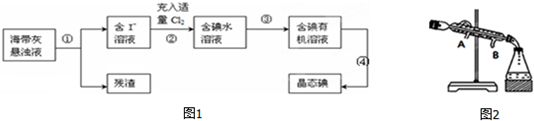
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
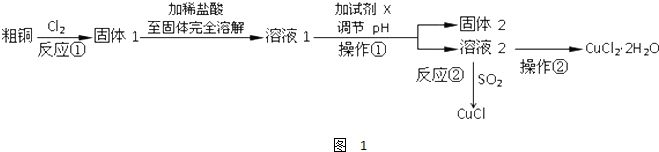

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com