
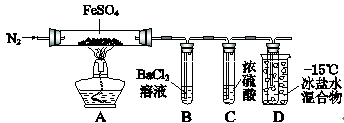
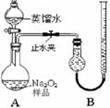
| | 实验过程 | 实验现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |


科目:高中化学 来源:不详 题型:实验题
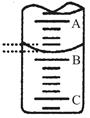
| A.c(Na+)>c(CH3COO—) | B.c(Na+)<c(CH3COO—) |
| C.c(Na+)=c(CH3COO—) | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠在空气中燃烧,生成淡黄色的氧化钠粉末 |
| B.镁在二氧化碳中燃烧,生成白色的氧化镁和黑色的炭 |
| C.将灼热的铁丝放人盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾 |
| D.在铜和浓硫酸加热反应后的混合液中加水,得到无色硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
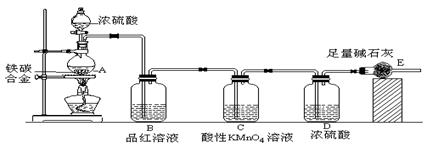
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3KJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 25.95 | 25.45 |
| 2 | 25.00 | 0.30、 | | |
| 3 | 25.00 | 6.00 | 31.55 | 25.55 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com