
| A、存在0.5 mol的CO |
| B、存在0.125 mol的O2 |
| C、存在0.25 mol的Na2CO3 |
| D、存在1.25 mol的Na2CO3 |
| 28x+44y |
| x+y |
| ||
| 28x+44y |
| x+y |
| 22.4L |
| 22.4L/mol |
| 3 |
| 1+4 |
| 1 |
| 3+1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
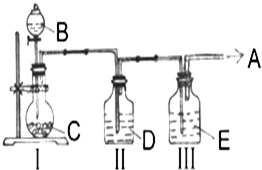 实验室中制取少量干燥纯净的气体A,可用如图装置
实验室中制取少量干燥纯净的气体A,可用如图装置查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | 质量(g) | 摩尔质量(g?mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO | 2- 3 |
| SO | 2- 4 |
| A、少量H2SO4溶液 |
| B、少量HNO3溶液 |
| C、足量NaOH溶液 |
| D、足量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
| B、为了使烧杯中的液体更快地升温,不垫石棉网而直接置于外焰上加热 |
| C、为加速固体物质的溶解可采用粉碎、振荡、搅拌、加热等方法 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com