
【题目】三氟化氮(NF3)是无色无味的气体,它可由氨和氟直接反应得到:4NH3+3F2![]() NF3+3NH4F。下列有关NF3的叙述正确的是
NF3+3NH4F。下列有关NF3的叙述正确的是
A. NF3是离子化合物 B. NF3中的N呈+3价
C. NF3的氧化性比F2强 D. NF3的还原性比NH3强
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为______________(填“吸热”或“放热”)反应。
(2)能判断该反应是否达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。该温度下,若向该容器中充入n(CO2)=1 mol,n(H2)=1 mol,4 min末达到平衡,CO2的转化率为_____________,H2的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5和PM10都是空气质量指数(AQI)的重要指标
B. 汽车尾气中的NO2和CO2都是大气污染
C. 聚乙烯和聚氯乙烯随意乱扔都能产生白色污染
D. 含N和P的大量污水任意排放都能导致水体富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号 | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s |
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10/span>-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.1 mol N2与足量的Mg完全反应,生成物中阴离子数为0.1 NA
B. 1 mol C2H5OH被O2完全氧化为CH3CHO,减少2 NA个C-H键
C. 2.24 L Cl2与足量NaOH溶液反应,转移的电子数目为0.1 NA
D. 1.0 g由H218O与D216O(1∶1)组成的混合物中所含中子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,Pka2=7.19。用0.1 mol/L NaOH溶液滴定20 mL 0.1 mol/L H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法不正确的是( )
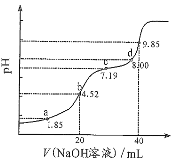
A. a点所得溶液中:2n(H2A)+n(A2-)=0.002mol
B. b点所得溶液中:c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c点所得溶液中:c(Na+)<3c(HA-)
D. d点所得溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i. ![]()
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1) A的名称是_______________;C的官能团的名称是_______________。
(2) B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_______________。
(3) E分子中含有两个酯基,且为顺式结构,E的结构简式为_______________。
(4)反应①的化学方程式为_______________________。
(5)试剂a的结构简式为_______________;反应②所属的反应类型为____________反应。
(6)已知Q为G的同分异构体,同时满足下列条件Q的个数为_______(不考虑立体异构)。
①1 mol Q可与足量的NaHCO3溶液反应生成1 mol CO2
②能发生银镜反应
③苯环上有三条支链
(7)已知氨基(-NH2)与-OH类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:

已知:
①1 mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、2 mol、1 mol。
②![]()
③
(R1、R2、R3为烃基或氢原子)
请回答:
(1)B→C的反应类型是__________,写出反应的化学方程式______________________。
(2)C→D反应的化学方程式是_______________________________________________。
(3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是__________。
已知E→G的反应类型是加成反应,写出反应的化学方程式_____________________。
(4)下列有关香兰醛的叙述不正确的是__________。
a. 香兰醛能与NaHCO3溶液反应
b. 香兰醛能与浓溴水发生取代反应
c. 1 mol香兰醛最多能与3 mol H2发生加成反应
(5)写出所有符合下列条件的香兰醛的同分异构体的结构简式___________________。
①苯环上的一硝基取代物有2种
②遇Fe3+显紫色
③含有![]() 结构
结构
(6)姜黄素的分子中有2个甲基,其结构简式是__________。
(7)1,3—丙二醇是重要的化工物质,请设计由甲醇和乙醇(其他无机试剂任选)合成它的流程图,合成路线流程图示例如下:__________________________________
CH2=CH2 ![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com