
下列关于金属的说法中,不正确的是( )
A.合金比纯金属具有较好的性能,硬度都比成分金属高,熔点比成分金属的低
B.在一般情况下,合金的硬度大于它的成分金属
C.常用电解法冶炼钠、镁、铝等活泼金属
D.将钢闸门与电源正极相连,可防止其在海水中被腐蚀
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
(1)生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)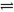 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
①已知:CH4(g)+3/2O2(g)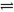 CO(g)+2H2O(g) △H1
CO(g)+2H2O(g) △H1
H2(g)+1/2O2(g)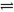 H2O(g) △H2
H2O(g) △H2
 则CH4(g)+H2O(g)
则CH4(g)+H2O(g)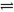 CO(g)+3H2(g)的△H=_____(用含△H1、△H2的式子表示)
CO(g)+3H2(g)的△H=_____(用含△H1、△H2的式子表示)
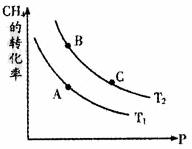
②一定条件下反应CH4(g)+H2O(g)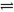 CO+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,则上述反应的△H________0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA________KB。
CO+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,则上述反应的△H________0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA________KB。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=___________,下列现象能说明该反应已经达到平衡状态的是___________(填写序号)

④在上述B点平衡基础上,向容器中再通入a mol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03 mol,则a=______________。
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+1/2O2(g)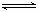 CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 | c(CO)/mol·L-1 | c(O2)/mol·L-1 | c(CO2)/mol·L-1 | v (正)和v (逆)比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v (正)= v (逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v (正)_____v (逆) |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为________________mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为____________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活息息相关,下列叙述错误的是( )
A.铁表面镀锌可增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含重金属离子的电镀废液不能随意排放
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | SO2 | Ca(OH)2 | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如图K72所示。
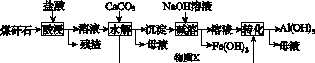
图K72
(1)写出“酸浸”过程中主要反应的离子方程式:
________________________________________________________________________、
________________________________________________________________________。
(2)“酸浸”时铝浸出率的影响因素可能有________________、________________。(写出2个)
(3)物质X的化学式为________。“碱溶”时反应的离子方程式为__________________________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。
为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
最新执行的国家食品卫生标准规定,酱油中3-氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm。相对分子质量为94.5的氯丙醇(不含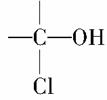 )共有( )
)共有( )
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)
C.c(OH-)>c(HF) D.c(HF)>c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化工生 产过程中所发生的反应不属于氧化还原反应的是( )
产过程中所发生的反应不属于氧化还原反应的是( )
A.用氯气和消石灰制漂白粉 B.用氢气和氮气合成氨
C.用铝土矿冶炼金属铝 D.用油脂制肥皂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com