
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
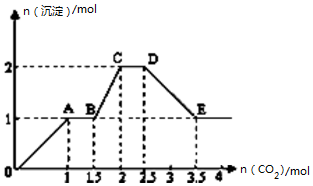 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 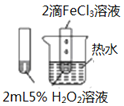 图验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 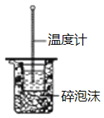 图用于中和热的测定 | |
| C. | 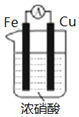 图用于探究Cu作负极的原电池原理 | |
| D. |  图用于比较盐酸、碳酸、硅酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 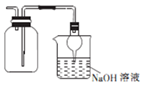 收集NO2并防止其污染环境 | |
| B. | 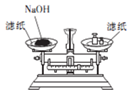 称取一定量的NaOH | |
| C. | 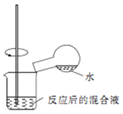 检验浓硫酸与铜反应后的产物中,是否含有铜离子 | |
| D. | 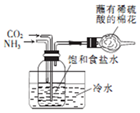 制取NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LH2O中含有极性键的数目为2NA | |
| B. | 78 g Na2O2中含有的阴离子数为NA | |
| C. | 11 g重水(D218O)中含有的电子数力5NA | |
| D. | 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢元素的离子的电子层排布与氖原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应;再向反应液中滴加酚酞 | 产生气体,气体可燃,溶液变浅红色 |
| ②向新制得Na2S饱和溶液中滴加新制氯水 | 生成淡黄色沉淀 |
| ③钠与滴有酚酞试液的冷水反应 | 浮于水面上,熔成小球,四处游动,逐渐缩小,溶液变红色 |
| ④镁带与2mol/L的盐酸反应 | 剧烈反应,产生的气体可燃 |
| ⑤铝条与2mol/L的盐酸反应 | 反应不十分剧烈;产生的气体可燃 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | 先生成白色絮状沉淀,最后沉淀全部溶解 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| ① | 不填 | 不填 |
| ② | S2-+Cl2=S↓+2Cl- | |
| ③ | 不填 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ④ | 不填 | 不填 |
| ⑤ | 不填 | 2Al+6H+=2Al3++3H2↑ |
| ⑥ | 先生成白色絮状沉淀,最后沉淀全部溶解 | Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com