
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对某类反应[aA(g)+bB(g)cC(g)]的化学平衡的影响,得到图像(图中p表示压强,T表示温度,n表示物质的量,α表示转化率)
反应Ⅰ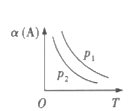 反应Ⅱ
反应Ⅱ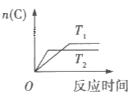
分析图像,回答下列问题:
(1)在反应I中,若![]() >
>![]() ,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
,则该反应的正反应为__________(填“放热”或“吸热”)反应,且为气体分子数__________(填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是__________
(2)在反应II中,![]() __________(填“>”,“<”或“=”)
__________(填“>”,“<”或“=”)![]() ,该反应的正反应为__________(填“放热”或“吸热”)反应。
,该反应的正反应为__________(填“放热”或“吸热”)反应。
【答案】放热 减小 低温 < 放热
【解析】
在有多个变量的平衡图像分析时,常采用“定一议二”、“先拐先平”的方法进行分析;根据G=H-TS<0进行分析。
(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应,即为熵减反应,△S<0,放热、熵减反应只能在低温下自发进行,故答案为:放热;减小;低温;
(2)反应Ⅱ中先拐先平温度高,T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,故答案为:<;放热。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.在含![]() 个硅原子的二氧化硅晶体中含有
个硅原子的二氧化硅晶体中含有![]() 个
个![]() 键
键
B.![]() 与
与![]() 的分子结构都是正四面体形,因此在
的分子结构都是正四面体形,因此在![]() 个
个![]() 分子或
分子或![]() 分子中都含有
分子中都含有![]() 个共价键
个共价键
C.5.6g![]() 与含0.2mol
与含0.2mol![]() 的溶液充分反应,至少失去
的溶液充分反应,至少失去![]() 个电子
个电子
D.![]() 个
个![]() 完全水解可以得到
完全水解可以得到![]() 个氢氧化铁胶体
个氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“生活无处不化学”,回答下列问题:
(1)用白醋浸泡开水壶,第二天发现壶内水垢消失,开水壶又光洁如新了(水垢的主要成分是碳酸钙等)。该离子反应方程式为____________。
(2)食盐不慎洒落在天然气的火焰上,观察到的现象是_____,该变化称为_____反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是____________。
(4)面包在制作时会加入小苏打,利用其加热产生气体的性质,可将小苏打作为膨松剂,该反应的化学方程式是________________。
(5)光导纤维、沙子、石英和玛瑙的主要成分是__________(填化学式)。
(6)赏心悦目的雕花玻璃是用__________(填名称)对玻璃进行刻蚀而制成的。
(7)使用“84”消毒液(含NaClO)时,按一定比例将它与水混合,并在空气中浸泡一段时间,使NaClO与H2O及空气中的CO2充分反应,以达到杀菌消毒的效果更好的目的。将该反应的离子方程式补充完整:![]() ____+____。
____+____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙、丁四个烧杯中分别放入![]() 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L。下列说法正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L。下列说法正确的是( )
A. 平衡向正反应方向移动 B. C的体积分数下降 C. B的转化率升高 D. x+y<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下,下列说法错误的是 ( )

A.反应①阶段,参加反应的 NaClO3 和 SO2 的物质的量之比为 2:1
B.反应②中的 H2O2 可以用 NaClO4 代替
C.反应②条件下,ClO2 的氧化性大于 H2O2
D.根据流程信息,可推测 NaClO3 氧化性强于 NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)下列是科研小组设计的一个甲醇燃料电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n相连接,工作原理示意图如图:

①b极电极反应式为____________。
②在标准状况下,若通入112mL的O2,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
(4)可利用CO2根据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
D.对2H2O2![]() 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com