
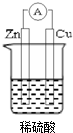
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:分析 (1)该原电池中,锌易失电子发生氧化反应而作负极,铜作正极,溶液中氢离子在此电极得到电子生成氢气;
(2)根据溶解和析出物质的质量相对大小判断溶液质量变化;
(3)根据转移电子相等计算生成气体的物质的量.
解答 解:(1)该原电池中,Zn易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-═Zn2+,铜作正极,正极上得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:负;氧化;2H++2e-=H2↑;
(2)该原电池中,负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气,电极反应式分别为:Zn-2e-═Zn2+、2H++2e-=H2↑,转移相同电子时,溶解锌和析出氢气的物质的量相等,锌的摩尔质量大于氢气,所以溶解锌的质量大于析出氢气的质量,所以溶液质量变大,
故答案为:变大;
(3)负极减少的质量1.3g,为金属锌的质量,原电池中正负极上转移电子相等,根据转移电子相等得,n(H2)=$\frac{1.3g}{\frac{65g/mol}{2}}$=0.02mol,
故答案为:0.02.
点评 本题考查了原电池原理、物质的量的计算等知识点,根据电极上得失电子确定正负极,再结合转移电子相等进行计算,难点是根据转移电子相等计算正极生成的气体的物质的量,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯分子比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氯化氢的电子式: | D. | 818O2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁加稀盐酸反应:Fe+2H+═H2↑+Fe2+ | |
| B. | 实验室用大理石和稀盐酸反应制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 钠投入水中:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25 mL 碱式滴定管量取14.80 mL NaOH 溶液 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 用托盘天平称取 25.20 g NaCl晶体 | |
| D. | 用广范pH试纸测得某碱溶液的pH为12.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,测得醋酸钠溶液的pH>7 | |
| B. | 醋酸可以使紫色石蕊试液变红 | |
| C. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快 | |
| D. | 常温下,测得0.1 mol/L醋酸溶液的pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O、31P | B. | 1H、12C | C. | 14N、23Na | D. | 24Mg、32S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
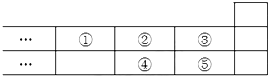
| A. | 元素①位于第二周期第IVA族 | |
| B. | 元素的最高正价是③=⑤ | |
| C. | 最高价氧化物对应水化物的酸性:③>⑤>④ | |
| D. | 气态氢化物的稳定性:④<②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com