
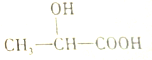
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成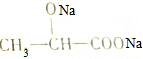 |
分析 A、1mol乳酸含有1mol羧基,可以与足量的NaHCO3反应生成1molCO2;
B、羟基和羧基都能与钠反应,且1mol羟基或羧基与钠反应生成0.5mol氢气;
C、与羟基相连的碳的邻位碳上有氢,故可以发生消去反应;
D、醇羟基不能与氢氧化钠反应.
解答 解:A、1mol乳酸含有1mol羧基,可以与足量的NaHCO3反应生成1molCO2,故A正确;
B、羟基和羧基都能与钠反应,且1mol羟基或羧基与钠反应生成0.5mol氢气,故1mol乳酸可以与2mol的钠反应生成1mol氢气,故B正确;
C、与羟基相连的碳的邻位碳上有氢,故可以发生消去反应,乳酸发生消去反应生成CH2=CHCOOH,故C正确;
D、醇羟基不能与氢氧化钠反应,故D错误.
故选D.
点评 有机物的结构决定性质,注意官能团所具有的化学性质是解题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应及实验目的 | 试剂X | 试剂Y |
| A | 电石与饱和食盐水混合, 检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
| B | 二氧化锰与浓盐酸混合加热, 验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
| C | 乙醇与浓硫酸加热至170℃, 证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 |
| D | 乙酸溶液与碳酸钠固体混合, 探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
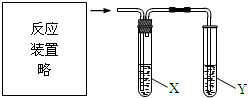
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
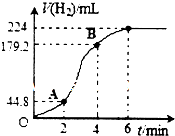
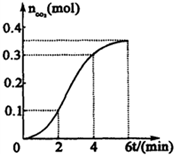 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子得电子能力减弱 | |
| D. | Na、K、Rb的电子层数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
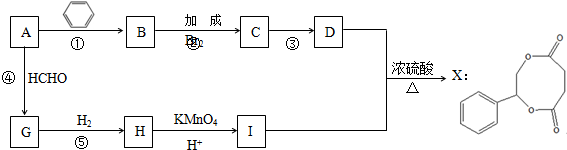
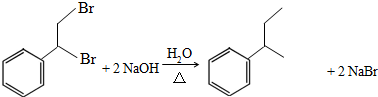 .
.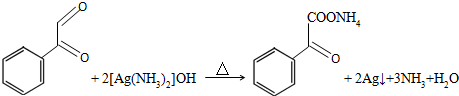 .
.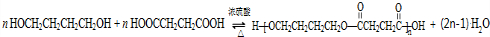 .
. 任意2种.
任意2种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com