
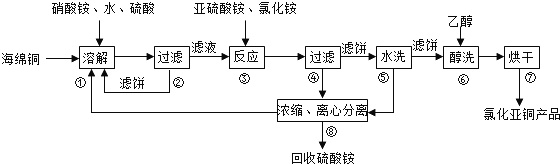
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解,
故答案为:CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,
故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化;
(5)步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,
故答案为:BD;
(6)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n ab×10-3mol
n=6ab×10-3mol,m(CuCl)=99.5g/mol×6ab×10-3mol=0.597abg,
则样品中CuCl的质量分数为$\frac{0.597ab}{m}$,
故答案为:$\frac{0.597ab}{m}$.
点评 本题为2015年高考题,题目考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等,注意(6)中利用关系式的计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 56g金属铁完全反应时失去的电子数为一定为2NA | |
| B. | 18g水所含的电子数目为NA | |
| C. | 在常温常压下,48g氧气和臭氧的混合气体所含的原子数目为3NA | |
| D. | 在常温常压下,11.2L二氧化硫所含的分子数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
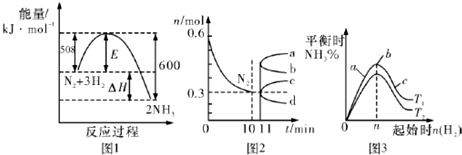
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
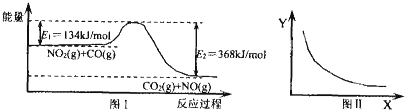
| A. | 该反应的焓变△H=+234 kJ•mol-1 | |
| B. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 | |
| C. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| D. | 若X表示反应时间,则Y表示的可能是混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
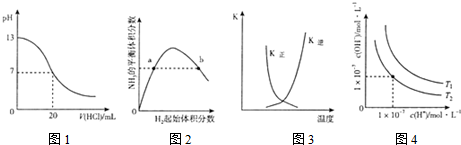
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数 | B. | 压强 | C. | 密度 | D. | 平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com