
(13分)(1)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) 2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。

①该反应的平衡常数表达式为K=___。升高温度,平衡常数将____(填“增大”“减小 ”或“不变”)。
”或“不变”)。
②能判断该反应是 否达到化学平衡状态的依据是________。
否达到化学平衡状态的依据是________。
A.容器中压强不 变
变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c( C)
C)
(2)为研究不同条件对反应2NO(g)+Cl2(g) 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为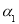 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为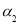 ,则
,则 __________
__________ ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。
(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为_________________。用该燃料电池作电源,以石墨为电极电解足量的硫酸铜溶液,当电路中通过0.1 mol电子时,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其 质量约为_______g。
质量约为_______g。
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是
A.三氯化硼液态时能导电而固态时不导电
B.三氯化硼加到水中使溶液的pH升高
C.三氯化硼分子呈正三角形,属非极性分子
D.分子中所有原子都满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:选择题
某反应2AB(g) C(g)+3D(g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+3D(g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0
C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
燃烧质量相同的下列各有机物时,消耗氧气的量最多的是
A.乙醇 B.丙醇 C.乙二醇 D.丙三醇
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列物质中属于同系物的是
①CH3CH2Cl ②CH2=CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3 ⑥CH3CH(CH3)2
A.①② B.①④ C.①③ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:

下列说法不正确的是
A.反应前2 min的平均速率υ(Z)=2.0×10—3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.向FeCl2溶液中通入C l2反应的离子方程式为:Fe2++Cl2=Fe3++2C1—
l2反应的离子方程式为:Fe2++Cl2=Fe3++2C1—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:
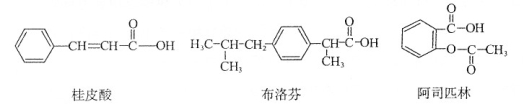
以下关于这三种有机物的说法中,不正确的是
A.都能与Na2CO3溶液反应产生CO2
B.一定条件下,均能与乙醇发生取代反应
C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应
D.1 rnol阿司匹林最多能与l mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:实验题
【实验化学】硫酸锌是一种重要的工业原料。在实验室从粗锌(含有少量的铅)与稀硫酸反应后的废液中提取硫酸锌的主要操作步骤如下:
步骤1:将废液过滤,调节滤液的pH约为2,过滤,将滤液加热浓缩,制得较高温度下的饱和溶液,冷却结晶得到粗制晶体。
步骤2:①在烧杯中用蒸馏水溶解步骤1得到的晶体,滴加少量稀硫酸,水浴加热至晶体全部溶解。
②停止加热,让其自然冷却、结晶。
③抽滤,用少量无水乙醇洗涤晶体1~2次,得精制晶体。
(1)废液中含有的不溶性杂质是________。
(2)步骤1中调节滤液pH约为2,可加入的物质是________(填字母)。
a.NH3·H2O b.ZnO c.ZnCO3 d.NaOH
(3)步骤1中对滤液加热浓缩时,当________时,停止加热。
(4)步骤2中滴加少量稀硫酸的目的是____。
(5)抽滤装置如图所示,仪器B的名称是________。仪器C的作用是____________。
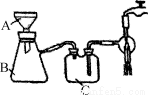
(6)用少量无水乙醇洗涤晶体的目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com